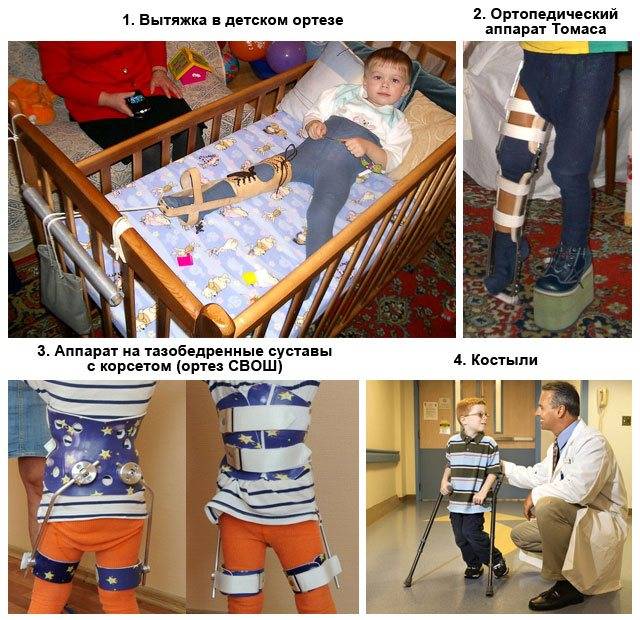
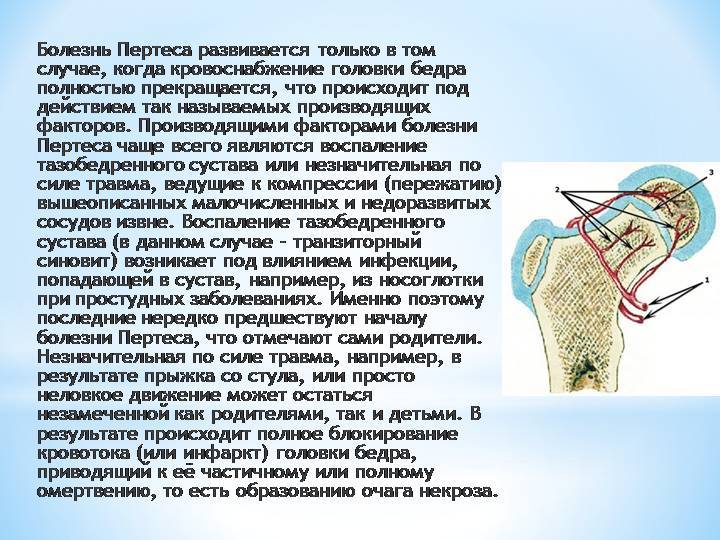
Группы диагнозов ОДА
Выделяют три группы диагнозов в зависимости от причины формирования нарушений:
- связанные с центральной нервной системой (церебральные параличи различного происхождения, паралитические синдромы, негативные последствия полиомиелита);
- врожденные аномалии развития (вывих бедра, деформированные и недоразвитые конечности);
- приобретенные заболевания, при которых двигательные механизмы нервной системы остаются сохранными, но имеются парезы, дефекты стоп или кистей, нетяжелая степень сколиоза, полиартрит (следствие травмирования или интоксикации, туберкулеза костей, онкологических заболеваний, рахита, хондродистрофии).
Симптомы неврологических заболеваний у детей
Первые признаки неврологических нарушений можно заметить у ребёнка уже в самом раннем возрасте. К доктору за помощью следует обратиться, если наблюдаются следующие симптомы:
- подёргивание подбородка и ручек в состоянии покоя;
- запрокидывание головы назад во время плача;
- отсутствие реакции на яркий свет и звук погремушки;
- неспособность удерживать погремушку через 30 дней после родов;
- неспособность удерживать головку через 30 дней после родов;
- обильное слюноотделение после кормления;
- гипервозбудимость (частый плач) или пассивное поведение (совсем не плачет);
- повышенная тревожность, нарушения сна (трудности с засыпанием, сон более 20 часов в сутки);
- частые срыгивания фонтаном;
- возникновение судорог при незначительном повышении температуры;
- гипертонус (постоянное напряжение) мышц ног, выгибание тела или наклоны головы в сторону, из-за этого ребёнка сложно переодеть;
- трудности с проглатыванием пищи;
- временные потери сознания;
- 3-месячный ребёнок не подражает речи взрослых;
- родничок впалый;
- ребёнок не желает желать на животе;
- при опоре на ножки ребёнок подгибает пальчики.
Что касается ребёнка старшего возраста, то тут симптомы неврологических заболеваний у детей будут несколько иными:
- забывчивость, рассеянность;
- обмороки;
- недержание мочи;
- задержка речевого развития;
- чрезмерная нервозность;
- приступы панических атак;
- ребёнок с трудом идёт на контакт с другими детьми;
- бессонница;
- плохой аппетит;
- постоянное уныние и тоскливое отношение к жизни;
- постоянная головная боль.
Если родители обнаружили даже некоторые из этих признаков, необходимо срочно проконсультироваться со специалистом.
Бруцеллезный артрит
Инфекционный специфический артрит, одно из частых проявлений бруцеллеза.
Возбудитель
Наиболее часто инфекцию у собак вызывает B. canis, к которой невосприимчивы сельскохозяйственные животные. Этиологическим агентом бывают также B. abortus, B. melitensis и B. suis.
Эпизоотология
Бруцеллез, вызываемый видом Brucella canis, регистрируется даже в тех странах, где бруцеллез других видов животных не встречается (Великобритания, Германия, Чехия, Словакия, Япония). В РФ Вг. canis впервые зарегистрирована в 1994 году в Волгоградской области.
Пути передачи
Возбудитель Brucella canis выделяется с мочой, спермой, выделениями из матки, с фекалиями, молоком, слюной. Brucella canis может сохраняться в сперме кобелей до нескольких месяцев. Опасность представляют не только зараженные бруцеллезом собаки, но и щенки от них.
Суки в период беременности более восприимчивы к бруцеллезу.
Переболевшие животные остаются носителями на протяжении от нескольких месяцев до нескольких лет и приобретают пожизненный иммунитет.
Клиническая картина
Инкубационный период – 2-3 недели.
- часто протекает бессимптомно (возможна продолжительная, до двух лет и более, бактериемия без лихорадки).
- полилимфаденопатия
- артриты. Поражаются обычно крупные суставы, при остром и подостром течении наблюдаются их опухание, болезненность, повышение температуры кожных покровов сустава, иногда — покраснение кожи и выпот, нарушение функции конечности. При хроническом течении возможно поражение периартикулярных тканей, мышц и подкожной клетчатки, в результате чего возникают бурситы, тендовагиниты, фиброзиты, миозиты.
- орхиты, простатиты и эпидидимиты
- аборты (частично разложившиеся плоды на 45-55-й день беременности), мертворожденные приплоды, в дальнейшем – хронические эндометриты. Может наблюдаться ранняя эмбриональная смерть, которая выглядит как бесплодие суки.
- зараженные щенки рождаются мертвыми или слабыми, а у выживших сильно увеличены лимфатические узлы.
- иногда инфекция связана с остеомиелитом, дискоспондилитом и рецидивирующим увеитом
Особенности диагностики
- Рентгенологических изменений при остром и подостром течении в суставах обычно не определяется. На рентгенограмме при хроническом артрите можно отметить костно-хрящевую деструкцию вплоть до анкилоза.
- Цитологическое исследование синовии: серозный, стерильный выпот.
- Серологические тесты: РА (1:200 и выше), РСК (1:20 и выше). Агглютинины в крови появляются в зависимости от способа заражения в сроки от 3-14 до 20 дней. Нарастание титра агглютинации в среднем происходит до 20-30-го дня после появления патологического титра. Щенки, родившиеся от больных матерей, в первые 2-3 мес имеют РА в низких титрах. С помощью РСК определяется большее количество положительно реагирующих собак, и реакция удерживается длительнее. При естественном течении болезни чаще встречаются животные с различной длительностью заболевания, поэтому комплексное использование РА и РСК позволит выявить больше больных.
- ПЦР синовии, патматериала
- Посев на кровяных культурах
Лечение
Являясь факультативными внутриклеточными паразитами, бруцеллы мало чувствительны к традиционной антибиотикотерапии, поэтому лечение считается сложным и малорезультативным, зачастую позволяя лишь снизить остроту заболевания. Лечение МОЖЕТ БЫТЬ эффективно, если оно начато не позже 6-ти месяцев после заражения! Антибиотикотерапия наиболее эффективна при остросептической форме. При хронической форме течения основное значение имеет вакцинотерапия.
- ЛС выбора применяются не менее 1,5 месяцев: Доксицилин (12,5 мг/кг, 2 раза в день орально) и стрептомицин 20 мг/кг/сут в/м 2 раза в день в течение 15 дней. Затем – доксициклин и рифампицин по10-20мг/кг/сут внутрь в 2 приёма в течение оставшихся 30 дней лечения.
- Альтернативные ЛС применяются также не менее 1,5 месяцев: Ко-тримоксазол по 10-20мг/кг/сут внутрь 2р/д и рифампицин внутрь по 10-20мг/кг/сут
Возможно повторение курса лечения.
Распространенные ошибки лечения
- Проведение коротких (менее 1,5 мес) или прерывистых курсов антибиотикотерапии.
- Проведение монотерапии.
- Проведение антибактериальной терапии при латентных формах.
Клинические симптомы
В большинстве случаев холецистит наблюдается как острое заболевание. Владельцы отмечают у животного тошноту, рвоту, отказ от корма, боли в области живота. Желтуха является необязательным симптомом, особенно если общий желчный проток свободен, и может проявляться не сразу. Ее появление в этом случае объясняется развитием неспецифического реактивного гепатита и внутрипеченочного холестаза в ответ на эндотоксины из воспаленного желчного пузыря. Холецистит, сопровождающийся застоем желчи, может приводить к ахолии и обесцвечиванию каловых масс. Появление на фоне этих симптомов лихорадки, синдрома острого живота и признаков септического шока (поверхностное дыхание, гипотермия, бледные десна и слабый, но частый пульс) может указывать на разрыв желчного пузыря и требует неотложных мероприятий.
Холецистит может быть хроническим и проявляться периодической тошнотой у животного, признаками дискомфорта после еды, потерей аппетита, снижением веса, диареей или протекать вообще без каких-либо симптомов (а изменения в желчном пузыре будут случайной находкой при ультрасонографии).
Влияние запора на организм
Если у ребенка запор, то он становится вялым, апатичным, снижается аппетит, появляется слабость на фоне всасывания вредных веществ из каловых масс, вследствие расстройства пищеварения.
Если ребенку не сходить в туалет, то это становится причиной его замкнутости, так как походы на горшок заканчиваются неприятными ощущениями и длительны по времени.
Нарушение отхождения стула приводит к появлению дисбаланса в составе микрофлоры кишечника, возникает нарушение всасывании и поступления питательных веществ, возникает дефицит микроэлементов у ребенка. Запор может стать причиной воспаления в стенке кишечника, повышению его моторики и возникновению сильных болей.
Запор нужно лечить, начиная с общих рекомендаций.
Самые частые симптомы расстройства
Типичные симптомы для синдрома Ретта – мышечные и двигательные нарушения. Мышцы находятся в гипертонусе или же, наоборот, теряют его. В этом случае у ребенка развивается неправильное положение тела, прогрессирует частичные параличи и нарушение координации. Например, девочки скрещивают ноги во время ходьбы.
Синкинезии – патологические сокращения мышц, возникают вслед за произвольным движением: простая улыбка способна вызвать резкий взмах ногой. Такое явление постепенно приводит к повреждению суставов, сухожилий и связок, провоцирует ортопедические нарушения. Последние проявляются во всевозможных деформациях и также очень часто сопровождают таких детей. Среди них выделяют вывих тазобедренного сустава, провоцируемый малой подвижностью.
Статическая деформация стопы чаще развивается из-за нарушенного мышечного тонуса. Распространенной считается патология под названием «конская стопа», связанная со снижением подвижности голеностопного сустава. Ее можно узнать по пятке, которая не достигает земли, стопа при этом смещается кнаружи или вовнутрь. Причина патологии – гипертонус икроножной мышцы.
Сколиоз – боковое искривление позвоночника, который провоцирует массу проблем у таких пациентов: деформации суставов и костей, боли во время ходьбы, в стоячем или сидячем положении, утрата способности передвигаться. Сколиоз грудного отдела вызывает легочную недостаточность. Появляются также проблемы с пищеварением.
У детей с синдромом Ретта наблюдается повышенное слюнотечение. Но это происходит не из-за избытка количества слюны, а потери способности сглатывать ее.
Нарушение питания может развиваться из-за частых приступов тошноты. Она появляется на любые аспекты питания: на определенный продукт, его температуру, на способ приготовления. Так, ребенок способен отрицательно реагировать на пищу, поданную кусочками, или на комочки в блюде.
Постоянная тошнота провоцирует отказ от питания, а значит, потерю в весе.
Плохое сглатывание слюны, которая регулирует кислотность в желудке, и повышенное внутрибрюшное давление вызывают желудочно-пищеводный рефлюкс, то есть забрасывание содержимого желудка в пищевод. Это чревато такими последствиями, как воспаление стенки пищевода, респираторные инфекции.
Малоподвижный образ жизни, неврологические расстройства, неправильное питание провоцируют возникновение запоров у детей с синдромом Ретта. Они носят тяжелый характер, поскольку способны вызывать закупорку кишечника и сильные боли.
Повышенное слюнотечение, тошнота, рефлюкс снижают потребление ребенком пищи и даже развивают на нее негативную реакцию. В результате этого ребенок теряет в весе. Этот процесс стоит строго контролировать, поскольку он чреват истощением.
Другое тяжелое расстройство связано с работой дыхательной системы, развивающееся вплоть до приступов апноэ. Это явление настолько часто среди детей с синдромом, что нередко стает причиной их гибели.
Важными патогномоничными признаками синдрома считаются проявления аутизма. Именно из-за них заболевание изначально считали одной из форм этого расстройства, а в настоящее время относят к болезням аутистического спектра.
Аутистические признаки проявляются в отстранении от окружающего мира, в том числе и от родственников. Ребенок замыкается в себе, может не откликаться, когда его зовут. Предпочитает одиночество. Дети боятся чужих людей и непривычных ситуаций.
Лицо такого ребенка становится похожим на каменное. Взгляд блуждающий или устремлен в одну точку. Поведение часто непредсказуемо: случаются приступы неутомимого смеха или плача. Склонны к самоповреждениям: царапают кожу, кусают пальцы, вырывают волосы.
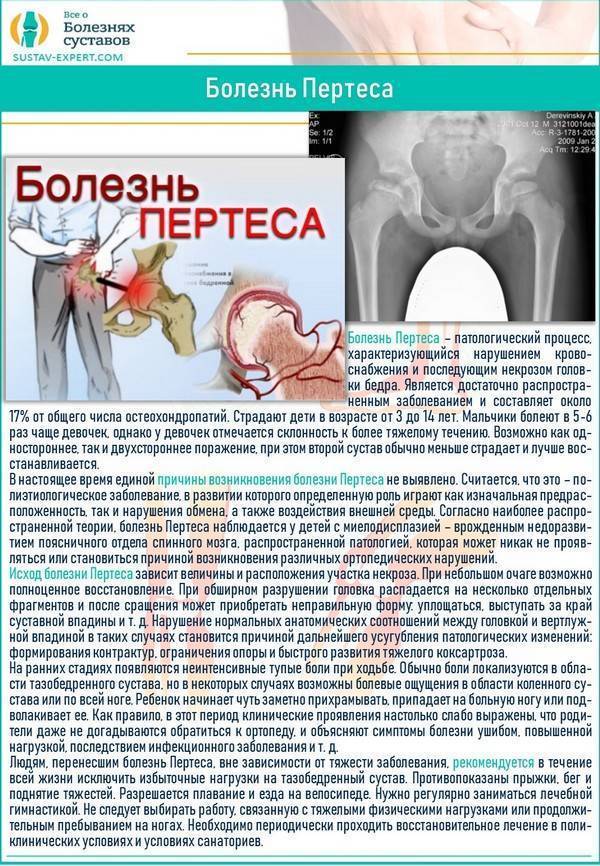
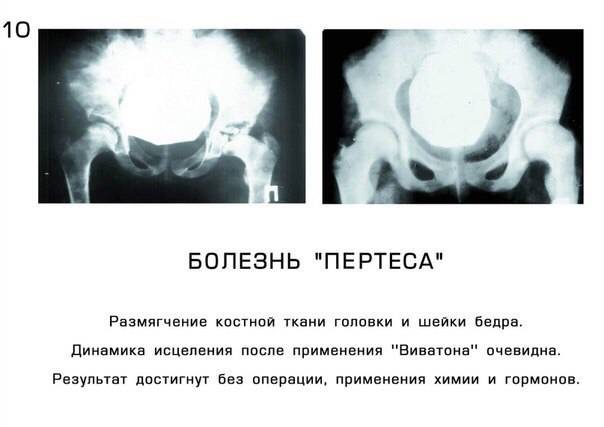
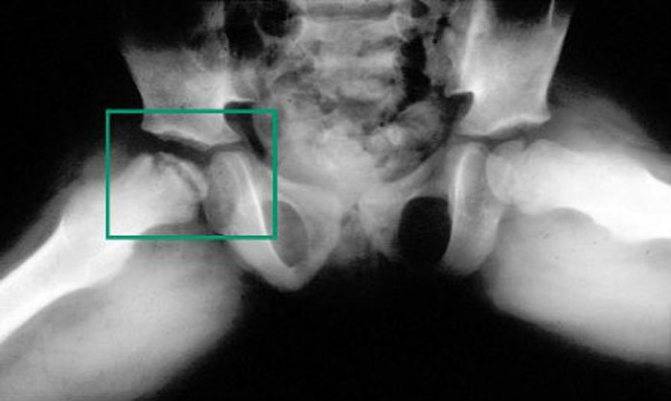
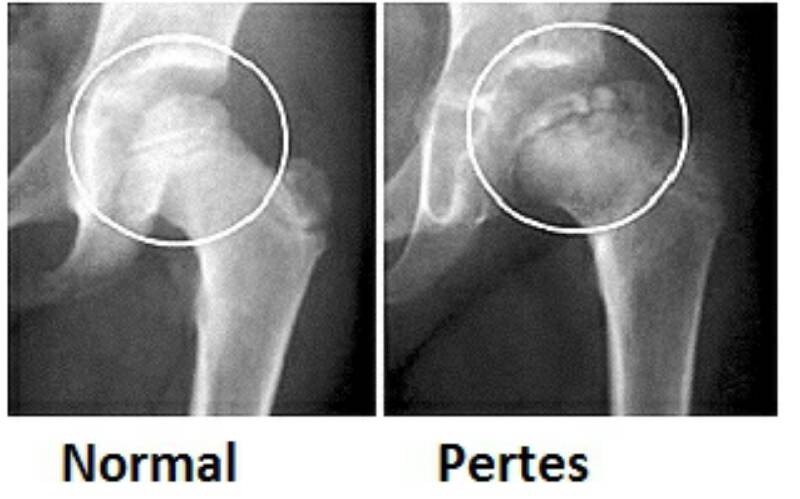
Что может стать причиной развития болезни Пертеса?
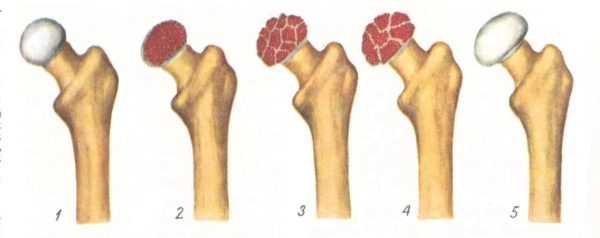
На сегодняшний день взгляды разных исследователей на причины развития болезни Пертеса значительно расходятся. Однако наиболее распространенная теория, к которой склоняется большинство учёных во всём мире, состоит в том, что определяющим условием возникновения болезни Пертеса является присутствие у ребенка определенных приобретенных или врожденных факторов. Так называемым «фоном» для развития болезни Пертеса считают миелодисплазию (недоразвитие спинного мозга) поясничного отдела, который непосредственно отвечает за иннервацию тазобедренного сустава. Недоразвитие спинного мозга носит наследственно-врожденный обусловленный характер, различается по степеням тяжести и наблюдается у значительной части детей. Легкая степень миелодисплазии может на протяжении всей жизни так и остаться незамеченной, тогда как более существенные нарушения в развитии спинного мозга проявляются целым рядом ортопедических заболеваний, к числу которых и относится болезнь Пертеса. Однако, хочется отметить, что данное заболевание развивается исключительно в случае полного прекращения кровоснабжения головки бедренной кости, что происходит под влиянием таких факторов как воспалительное поражение тазобедренного сустава или его травмирование, приводящие к пережатию извне недоразвитых и малочисленных сосудов. Помимо этого к предполагаемым причинам развития этой болезни относят болезни обмена веществ, осложнения инфекционных заболеваний, чрезмерную нагрузку на суставы (особенно при ослабленном организме).
К факторам риска развития болезни Пертеса относятся:
Высокие постоянные физические нагрузки у детей, чей рост уменьшен по сравнению с детьми своей возрастной группы;
Дети, которые подвержены воздействию табачного дыма (пассивные курильщики);
Дети, перенесшие рахит и гипотрофию.
Замечено, что чаще болезнь Пертеса встречается у мальчиков в возрасте от 3-х до 14 лет – они болеют в 3-5 раз чаще девочек. Статистика также утверждает, что мальчики, родившиеся с весом менее 2-х килограммов, в 5 раз чаще предрасположены к данному заболеванию, чем те, которые весили больше 3,5 килограммов.
Болезнь Лайма
Возбудитель
Возбудители БЛ относятся к роду Borrelia семейства Spirochaetaceae. Патогенные для человека и животных виды боррелийобъединяют в комплекс Borrelia burgdorferi sensu lato (s.l.). На территории России циркулирует 3 вида боррелий.
Пути передачи
Переносчиками боррелий являются клещи рода Ixodes, резервуаром – грызуны и олени. Достоверные случаи заражения боррелиозом людей от собак не описаны.
Клинические признаки
Первым клиническим проявлением болезни Лайма после укуса зараженным клещом обычно является хромота. Как правило, в первую очередь поражается сустав, располагающийся ближе всего к месту покуса, но иногда болезнь поражает и два-три сустава. Клинические признаки чаще всего проявляются между 2-м – 5-м месяцем после укуса клеща.
Вначале наблюдается легкая хромота. На второй – третий день животное перестает опираться на пораженную конечность. При пальпации пораженных суставов наблюдается припухлость и повышение местной температуры. У большинства животных в этот период отмечается повышение температуры тела. На четвертый день хромота обычно становится менее выраженной и затем пропадает. После первого периода хромоты наступают второй и третий с интервалом 2-4 недели. Как правило, наблюдаются изменения тех же суставов, что и при первом эпизоде хромоты, но могут быть поражены и другие. Более поздние периоды хромоты становятся продолжительнее и приводят к эрозивным изменениям суставной поверхности.
Поражения суставов при БЛ разнообразны – от умеренных артралгий до хронического деструктивного артрита. Артралгии и миалгии, скованность в суставах и позвоночнике, возникающие в первые дни болезни, являются частью общевоспалительного синдрома, характерного для этого заболевания.
Продолжительность болезни – от 3 месяцев до 3-4 и более лет.
Гистологическое и цитологическое исследование
Патологические изменения в суставах гистологически были выявлены даже у собак с минимальными признаками или отсутствием хромоты. Характерны гнойно-фибринозный артрит и синовит. Фибрин и нейтрофилы в полости сустава могут формировать плотные отложения. Воспаление в глубоких слоях синовиальной мембраны незначительное.
Состав синовиальной жидкости при Лайм-артрите не отличается специфичностью и обычно отражает умеренное воспаление. В большинстве случаев отмечается лейкоцитоз от 7000 до 50000 клеток/мкл. Содержание общего белка немного повышено, в пределах 4-9 г/декалитр. Анализ синовиальной жидкости при Лайм-артрите важен, поскольку имеет значение для правильной диагностики и необходимости исключения других заболеваний суставов.
Серологические методы
Выработка антител начинается через 3-4 недели после заражения, примерно совпадая по времени с развитием клинических признаков артрита.
Антитела отмечаются как у собак с клиническими проявлениями, так и у бессимптомных, но у последних несколько реже, к тому же титры антител у них обычно ниже. В течение болезни отмечается повышение титров антител в острый период. У собак-хроников титры обычно постоянные. После лечения уровень антител падает, но через некоторое время стабилизируется на относительно высоком уровне (но более низком, чем до лечения).
Лечение
Антибиотики тетрациклинового ряда или цефалоспорины. Из спектра ветеринарных инъекционных препаратов рекомендовано применение инъекционной формы окситетрациклина гидрохлорида – энгемицина 10% и цефалоспорина 4 поколения – кобактана (Intervet/Schering-Plough Animal Health).
Специфической особенностью возбудителей боррелиоза является длительное (до нескольких месяцев и даже лет) сохранение небольшого количества их в тканях, особенно в богатых коллагеном, не только при хроническом течении инфекции, но и после самопроизвольного выздоровления животного, несмотря на наличие иммунного ответа хозяина, а иногда даже после лечения антибиотиками. Патология при этом, как правило, отсутствует. Но возможен рецидив даже после лечения антибиотиками.
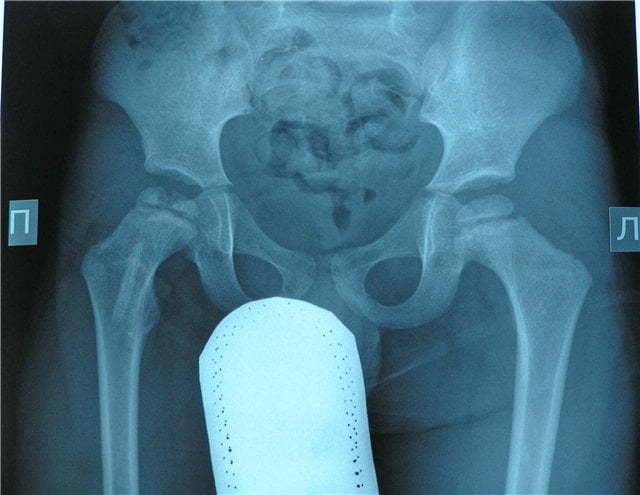
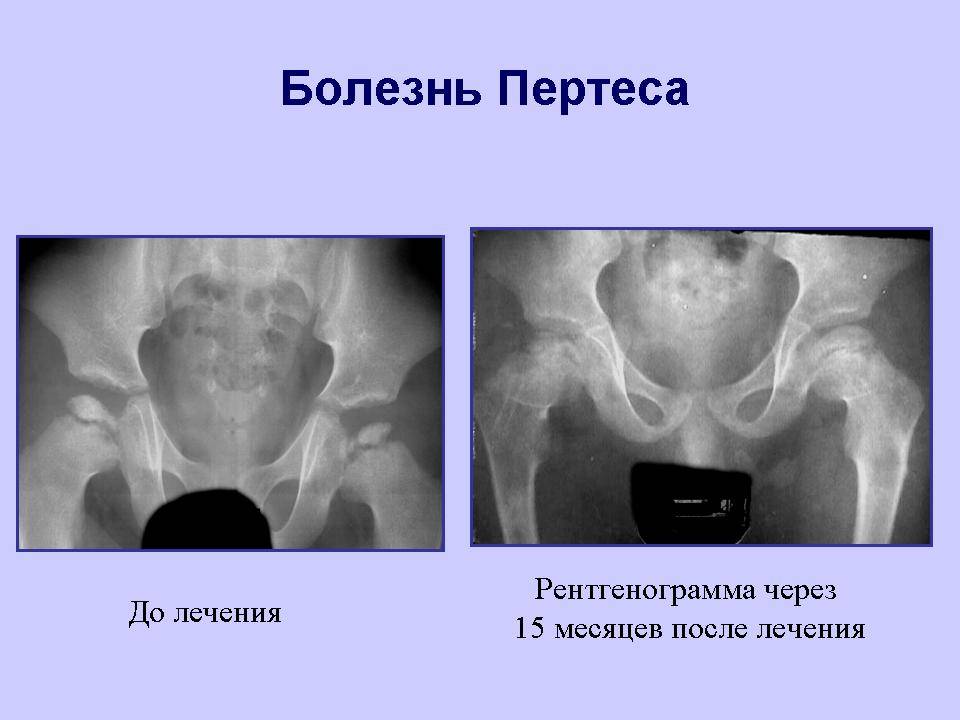
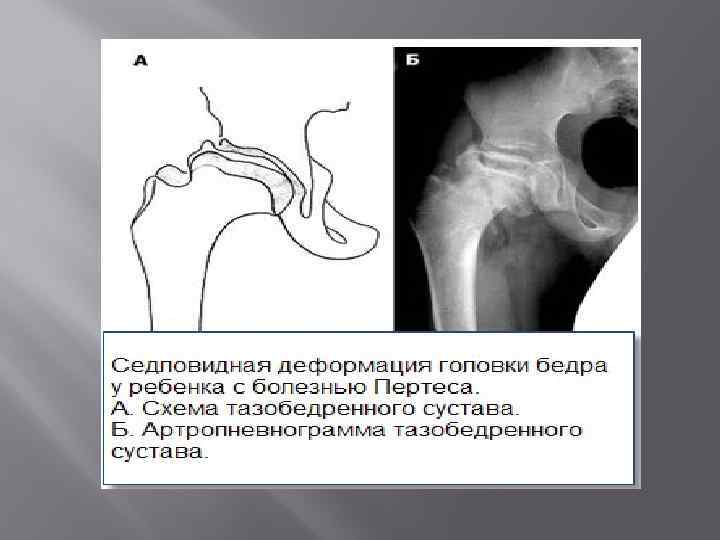
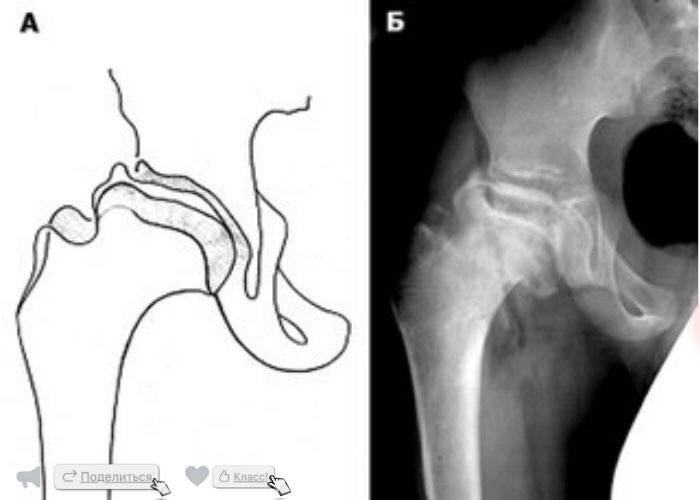
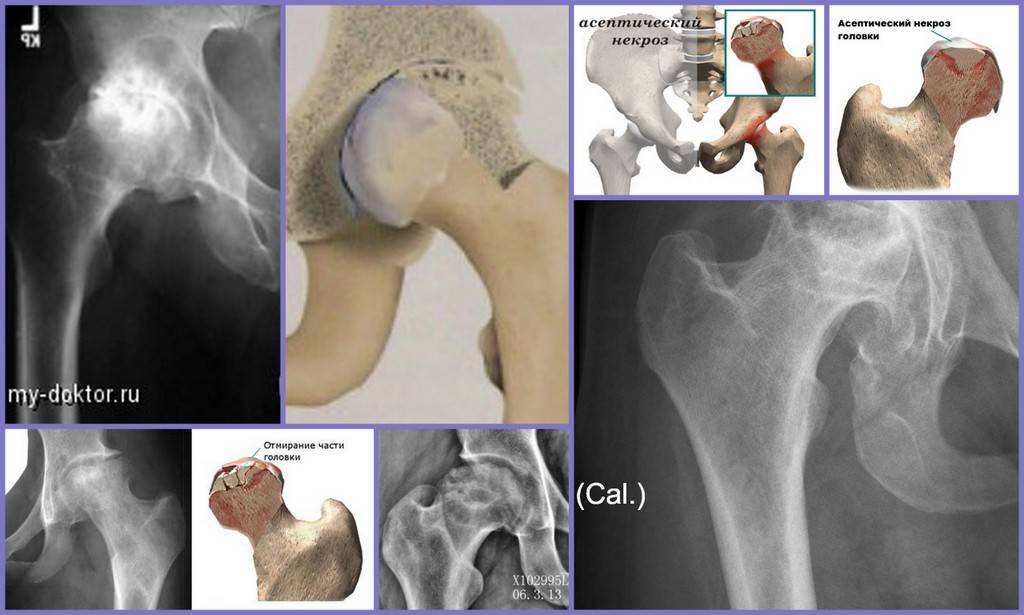
Краткий обзор болезни Пертеса у детей
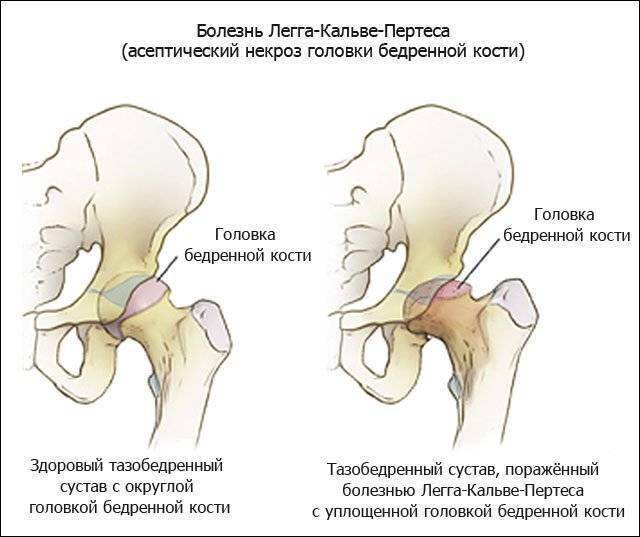
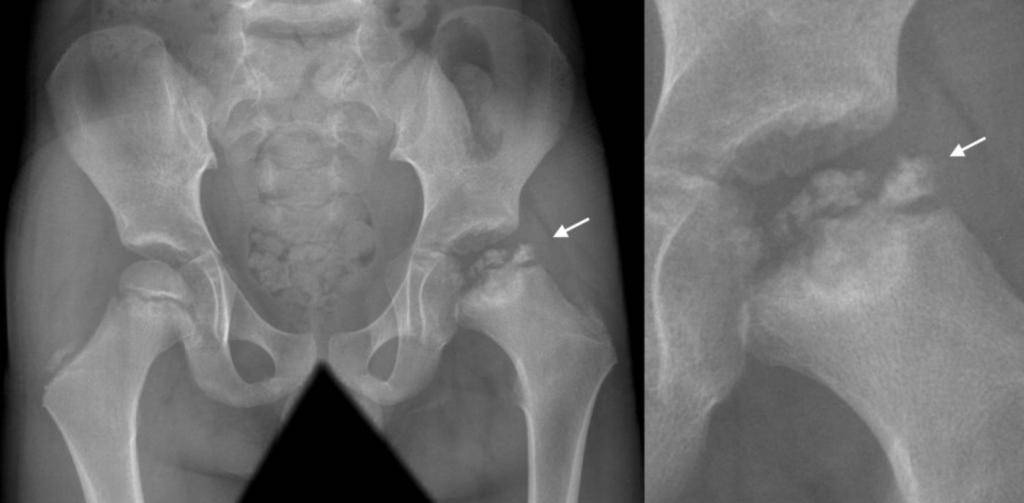
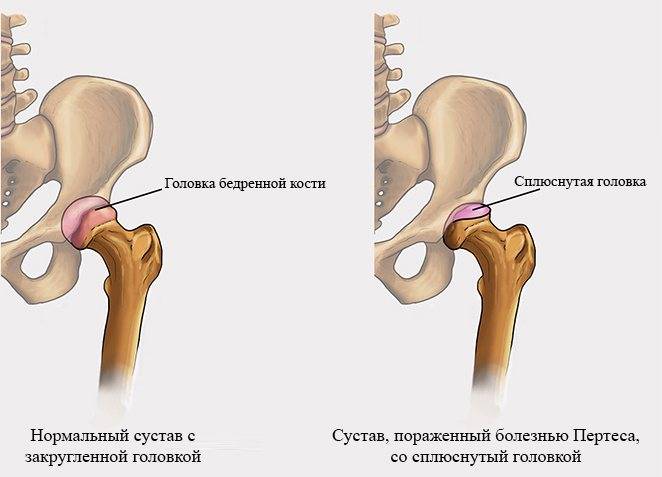
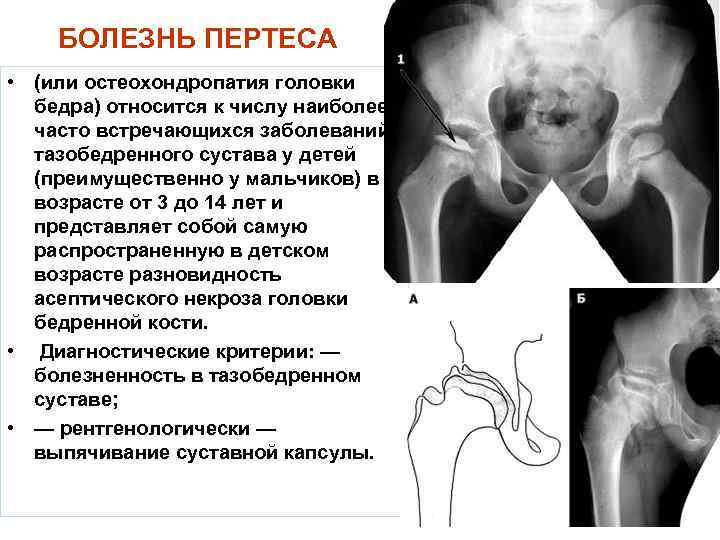
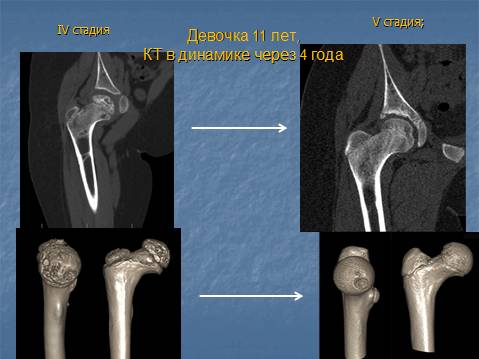
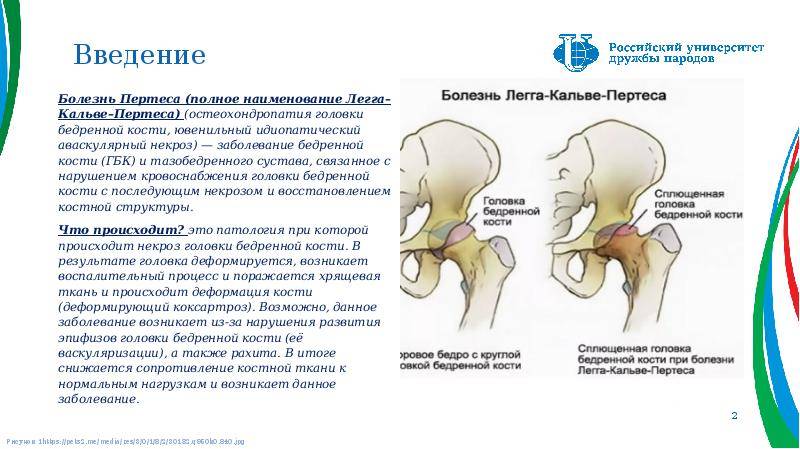
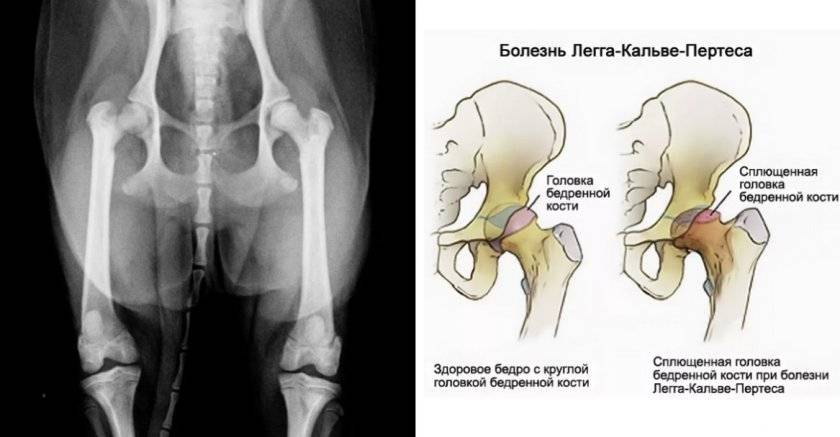
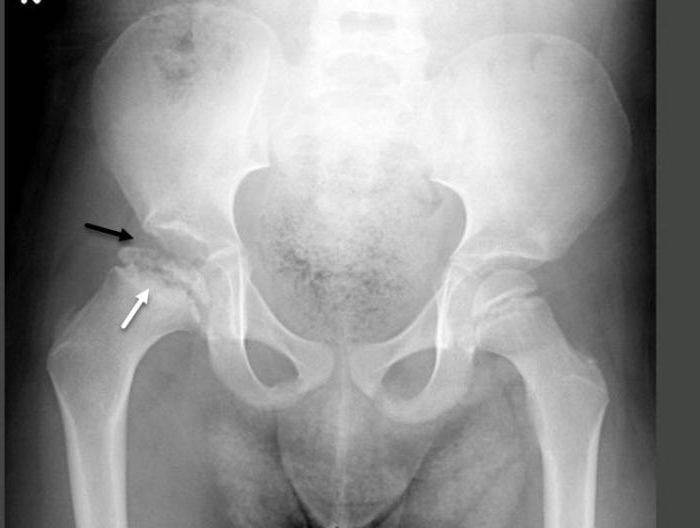
Болезнь Пертеса (остеохондропатия головки бедренной кости, асептический некроз головки бедренной кости у детей, субхондральный некроз ядра окостенения головки бедренной кости) — патологическое состояние, относящееся к остеохондропатиям. Полное название нозологии — Легга-Кальве-Пертеса.
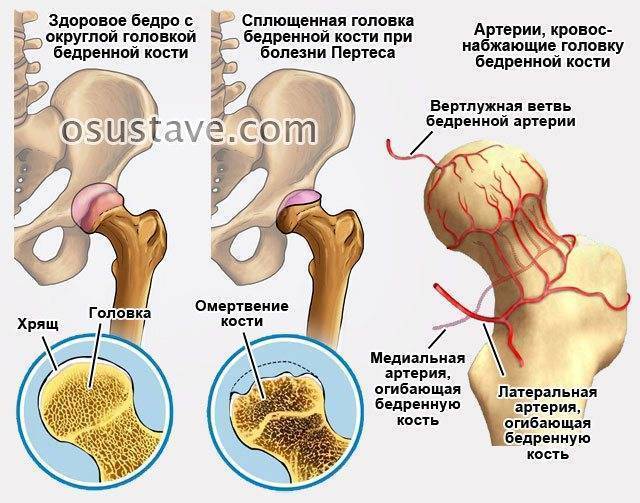
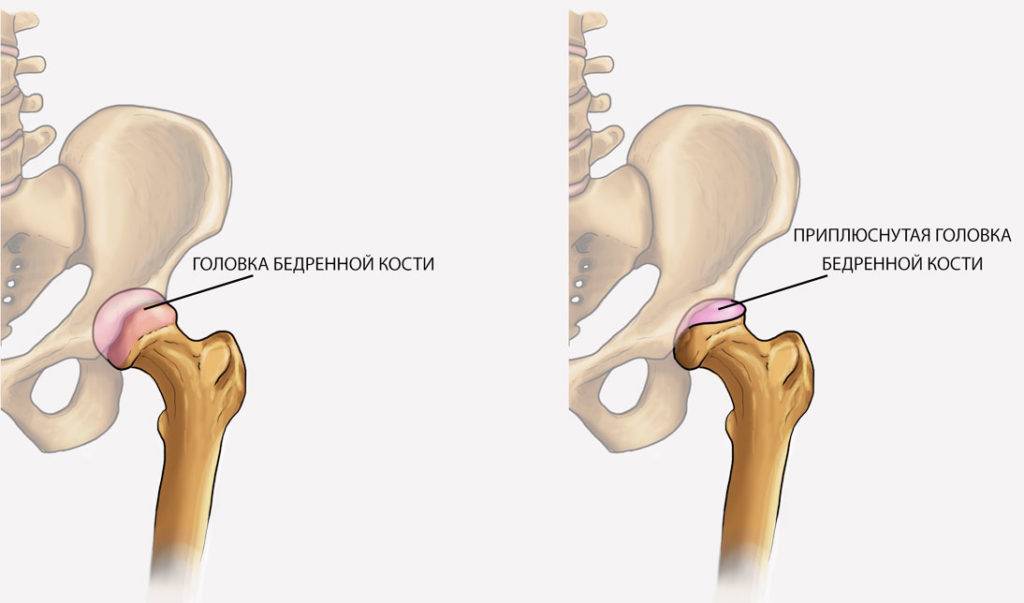
В основе болезни Легга-Кальве-Пертеса лежит неполноценность кровотока в мелких кровеносных сосудах. Как следствие, нарушается питание кости, возникают нарушения некротического характера и реорганизации кости. В итоге головка бедренной кости разрушается.
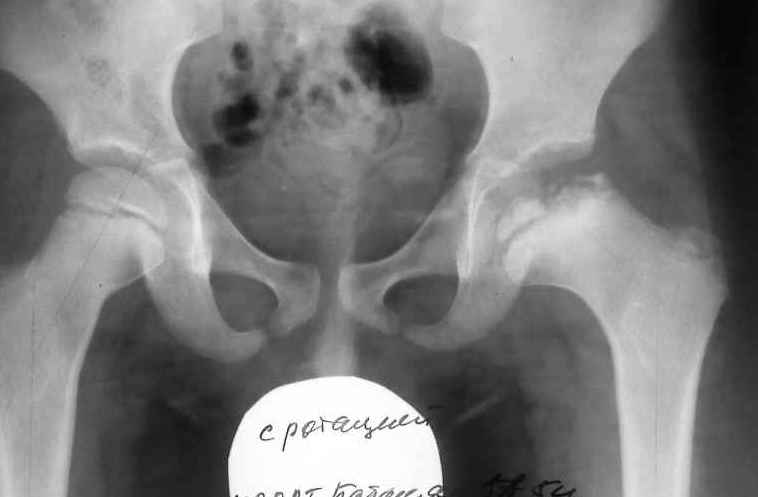
Абсолютное большинство больных болезнью Пертеса — мальчики 3 — 14 лет. Девочки страдают патологией в пять раз реже, но болезнь Пертеса у них протекает тяжелее. Как правило, поражается одно сочленение, но наблюдаются и двусторонние процессы. Основная причина, вызывающая асептический некроз головки бедренной кости у детей — хронические перегрузки и приобретенная или врожденная неполноценность опорно-двигательной системы, недавние острые инфекционные процессы и травмы, гормональный дисбаланс (переходный возраст или прием гормональных препаратов), генетическая склонность.
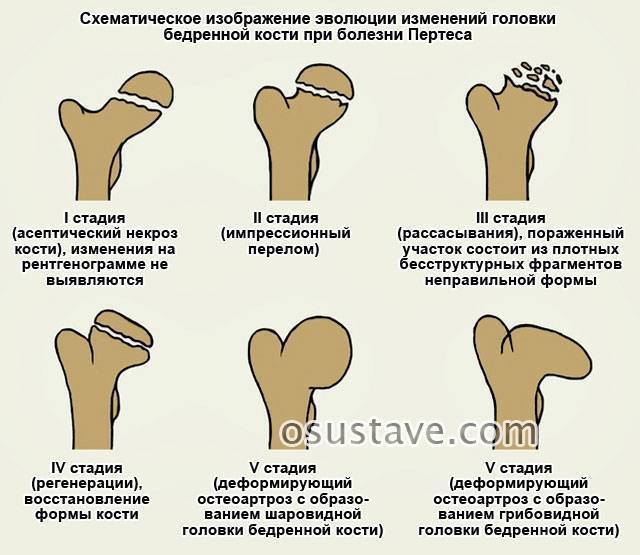
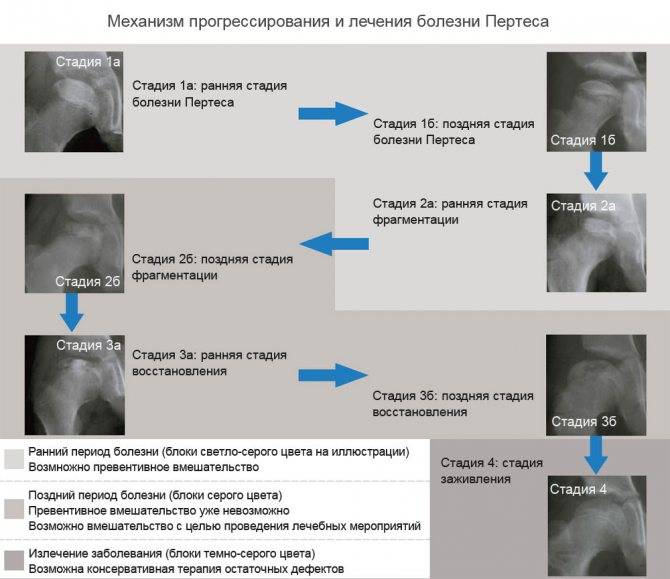
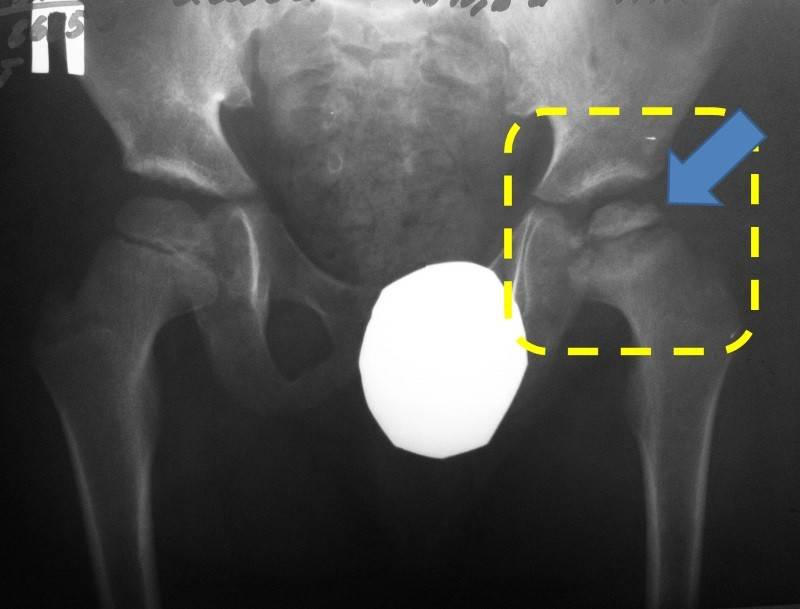
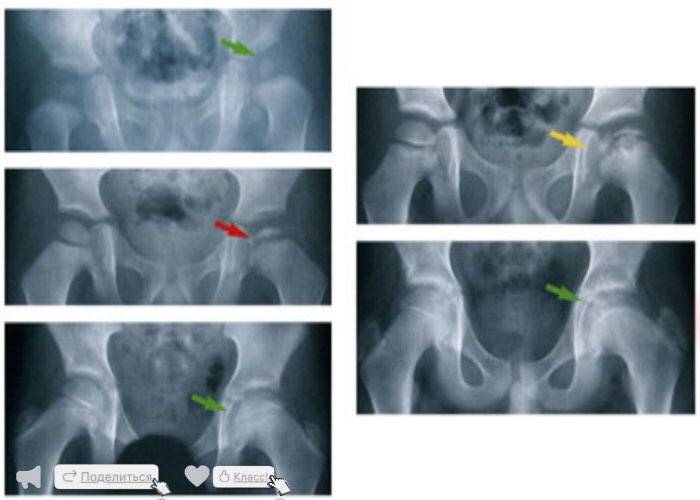
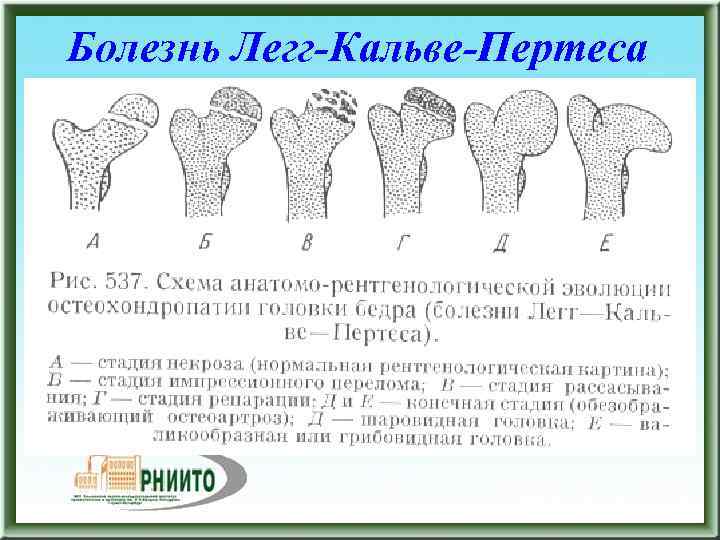
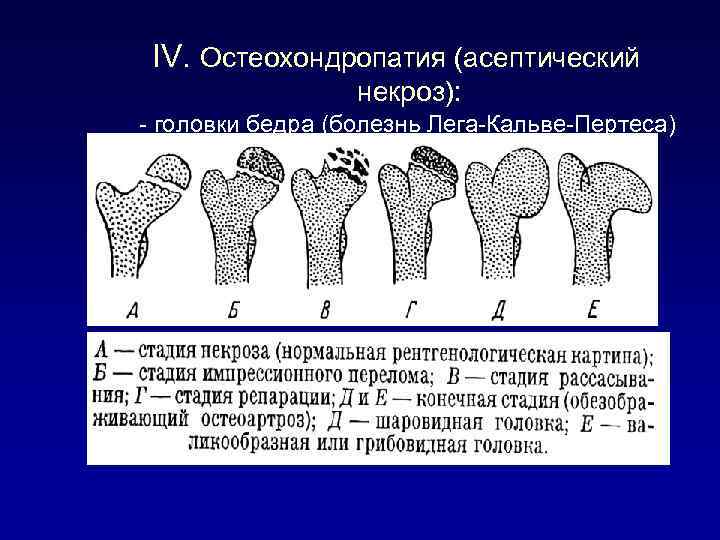
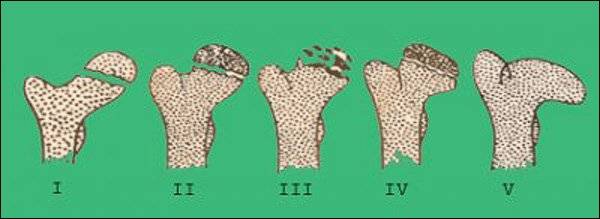
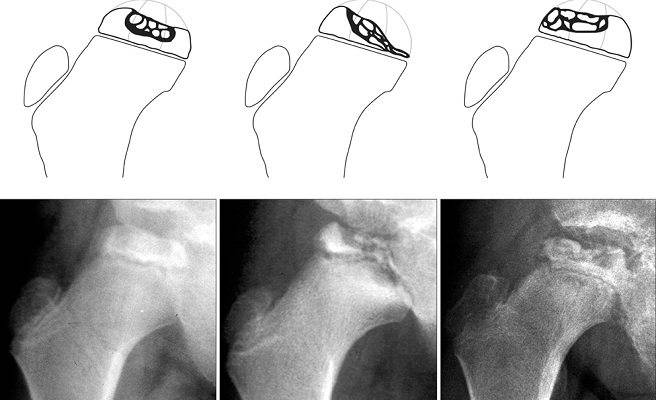
Течение болезни Петерса (остеохондропатии головки бедренной кости) разделяютт на пять стадий:
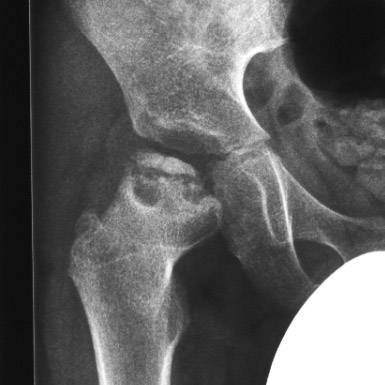
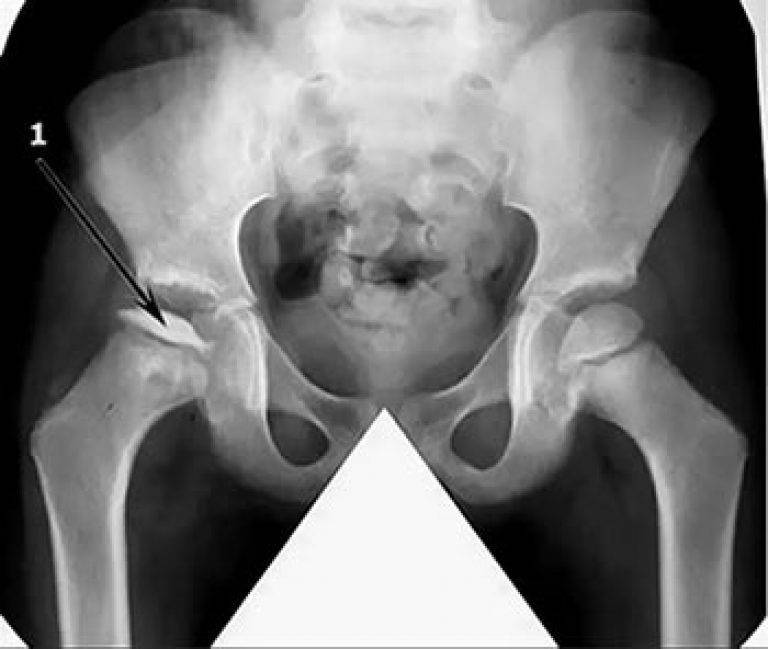
- I — жалобы на боль и утомляемость после ходьбы, заметно незначительное нарушение походки, наблюдаются микроскопические патологические изменения в костной ткани, а именно развивается субхондральное омертвение. Рентгенографические изменения затрагивают до 10% площади головки тазобедренного сустава. Начатое на данном этапе лечение позволяет полностью предотвратить дегенерацию тканей;
- II — появляются неприятные ощущения в тазобедренном суставе. Наблюдаются патологические переломы. От структурных изменений страдает до трети площади головки бедренной кости;
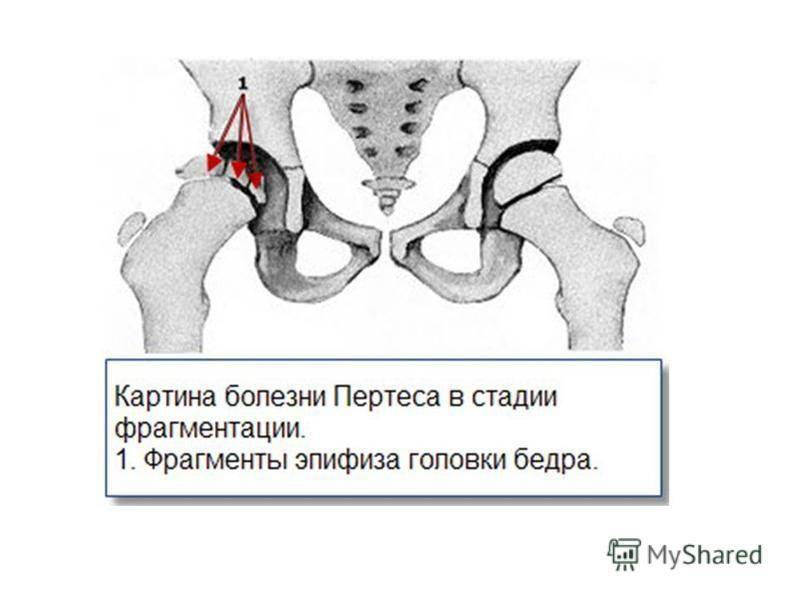
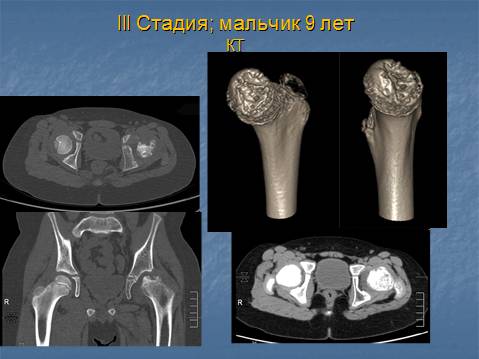
- III — длится 1,5 — 3 года, характеризуясь вялым течением. Внешние проявления болезни становятся более выраженными. Боль проявляется не только при ходьбе, но и в покое. Мышечные ткани на пораженной стороне атрофируются, амплитуда движений снижается, ребенок хромает. На снимках хорошо заметно, как головка бедренной кости буквально разваливается на фрагменты;
- IV — это восстановительная фаза болезни. В этот момент на омертвевших участках начинается нарастание костной ткани. Болевой синдром уменьшается, но амплитуда движений остается ограниченной. Скелетные мышцы пораженной конечности практически утрачивают способность к сокращению;
- V — характеризуется нарастанием костной ткани и восстановлением кости. При правильном и своевременно начатом лечении здоровье ребенка полностью восстанавливается.
Согласно Международной классификации болезней Х просмотра (МКБ 10), болезни Пертеса (субхондральному некрозу ядра окостенения головки бедренной кости) присвоен код М91.1.
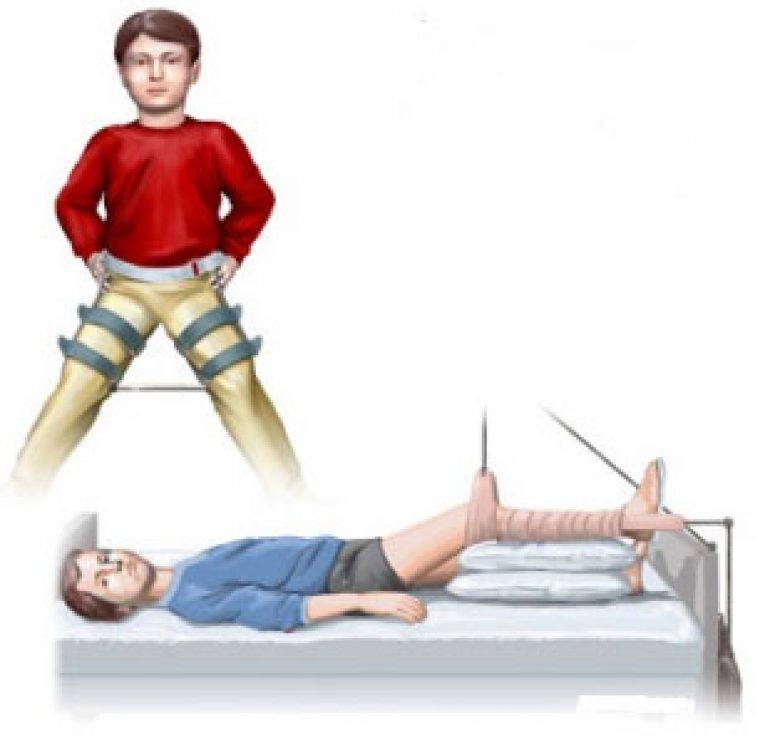
ЗАКЛЮЧЕНИЕ
Представленная технология центрирующей остеотомии бедра в сочетании с неартикулирующей аппаратной декомпрессией, туннелизацией шейки и головки, субхондральной клеточно-тканевой трансплантацией может эффективно применяться при лечении тяжелых форм болезни Пертеса в качестве альтернативы известным хирургическим вмешательствам.
ЛИТЕРАТУРА
1.Гафаров Х. З. Лечение детей и подростков с ортопедическими заболеваниями нижних конечностей. Казань : Татарское кн. изд-во, 1995.
2.Заболевания тазобедренного сустава у детей / И. Ахтямов, А. Абакаров, А. Белецкий, А. Богосьян, О. Соколовский. Казань : Центр оперативной печати, 2008. 456 с.
3.Минеев К .П., Белякова Л. А. Клинико-теоретическое обоснование активной хирургической тактики при комплексном лечении болезни Пертеса. М.: Сибирская книга, 1997. 112 с.
4.Моделирующее влияние тройной остеотомии таза на проксимальный отдел бедра при болезни Пертеса. /О.А. Соколовский, А. Б. Деменцов, А. В. Белецкий, Г. А. Бродко // Новости хирургии. 2009. Т. 17, No 3. С. 112-120.
5.Шевцов В. И., Макушин В. Д. Остеохондропатия тазобедренного сустава. М.: Медицина, 2007. 352 с.
6.A paired study of Perthes’ disease comparing conservative and surgical treatment / M. Kamegaya, T. Saisu, N. Ochiai, J. Hisamitsu, H. Moriya // J.Bone Joint Surg. Br. 2004. Vol. 86-B, No 8. P. 1176-1178.
7.Avascular necrosis of the femoral head in childhood: the results of treatment with articulated distraction / M. Kucukkaya, Y. Kabukcuoglu, I. Ozturk, U. Kuzgun // J. Paediatr. Orthop. 2000. Vol. 20, No 6. P. 722-728.
8.Arthrodiastasis in Perthes’ disease. Preliminary results / S.L. Maxwell, K.J. Lappin, W.D. Kealey, B.C. McDowell, A.P. Cosgrove // J. Bone Joint Surg. Br. 2004. Vol. 86-B. No 2. P. 244-250.
9.Arthrodiastasis of the hip / G.A. Hosny, K. El-Deeb, M. Fadel, M. Laklouk // J. Pediatr. Orthop. 2011. Vol. 31, Suppl. 2. P. 229-234. doi: 10.1097/BPO.0b013e318223b45a.
10.Baker K., Brown T., Brand R. A finite-element analysis of the effects of intertrochanteric osteotomy on stresses in femoral head necrosis // Clin. Orthop. Relat. Res. 1989. Vol. 249. P.183-188.
11.Catterall A. The natural history of Perthes’ disease // J. Bone Joint Surg. Br. 1976. Vol. 53-B, No 1. P. 37-53.
12.Femoral osteotomy in Perthes’ disease. Results at maturity / C.J. Coates, J.M. Paterson, K.R. Woods, A. Catterall, J.A. Fixsen // J. Bone Joint Surg. Br. 1990. Vol. 72-B, No 4. P. 581-585.
13.Hefti F., Clarke N.M. The management of Legg-Calve ́-Perthes’ disease: is there a consensus? : A study of clinical practice preferred by the members of the European Paediatric Orthopaedic Society // J. Child. Orthop. 2007. Vol. 1, No 1. P. 19–25. doi: 10.1007/s11832-007-0010-z.
14.Herring J.A., Kim H.T., Browne R. Legg-Calve-Perthes disease. Part II: prospective multicenter study of the effect of treatment on outcome // J.Bone Joint Surg. Am. 2004. Vol. 86-A, No 10. P. 2121-2134.
15.Ilizarov fixator for the treatment of Legg-Calve-Perthes disease / M. Kocaoglu, O.I. Kilicoglu, S.B. Goksan, M. Cakmak // J. Pediatr. Orthop. B. 1999. Vol. 8, No 4. P. 276-281.
16.Innominate osteotomy in Legg-Calve-Perthes disease / S.T. Canale, A.F. D’Anca, J.M. Cotler, H.E. Snedden // J. Bone Joint Surg. Am. 1972. Vol. 54-A, No 1. P. 25-40.
17.Innominate osteotomy for Perthes’ disease / M. Stevens, P. Williams, M. Menelaus // J. Pediat. Orthop. 1981. Vol. 1, No 1. P. 47-54.
18.Intertrochanteric varus osteotomy for Perthes’disease. Radiographic changes after 2-16-year follow-up of 126 hips / V. Hoikka, M. Poussa, T.Yrjönen, K. Osterman // Acta Orthop. Scand. 1991. Vol. 62. No 6. P. 549-553.
19.Joseph B., Srinivas G., Thomas R. Management of Perthes disease of late onset in southern India. The evaluation of a surgical method // J Bone Joint Surg. Br. 1996. 78-B, No 4. P. 625-630.
20.Klisic P. J. Treatment of Perthes’ disease in older children // J. Bone Joint Surg. Br. 1983. Vol. 65-B, No 4. P. 419-427
Сведения об авторах:
1.Тёпленький Михаил Павлович – ФГБУ «РНЦ «ВТО» им. акад. Г.А. Илизарова» Минздрава России, заведующий травматолого-ортопедическим отделением No 9, заведующий лабораторией патологии суставов, д. м. н.
2.Парфёнов Эдуард Михайлович – ФГБУ «РНЦ «ВТО» им. акад. Г.А. Илизарова» Минздрава России, травматолого-ортопедическое отделение No 9, врач ортопед-травматолог.