Методы исследования
Заболевание может быть выявлено на плановом обследовании у кардиолога в первый год жизни ребенка. Если этого не произошло и появились явные симптомы, производится сбор анамнеза, пациент осматривается на предмет оценки цвета кожных покровов, характера дыхания, внутригрудных шумов. Далее требуется аппаратная диагностика, которая проводится следующими способами:
- ЭКГ. Показывает перегрузку в работе правосторонней части органа.
- Рентгенография. Проявляет усиленный легочный рисунок, увеличение легочной артерии и сердечной тени на снимках.
- Рентгеноскопия. Фиксирует усиление пульсации легочных корней, что является специфическим симптомом ДМПП.
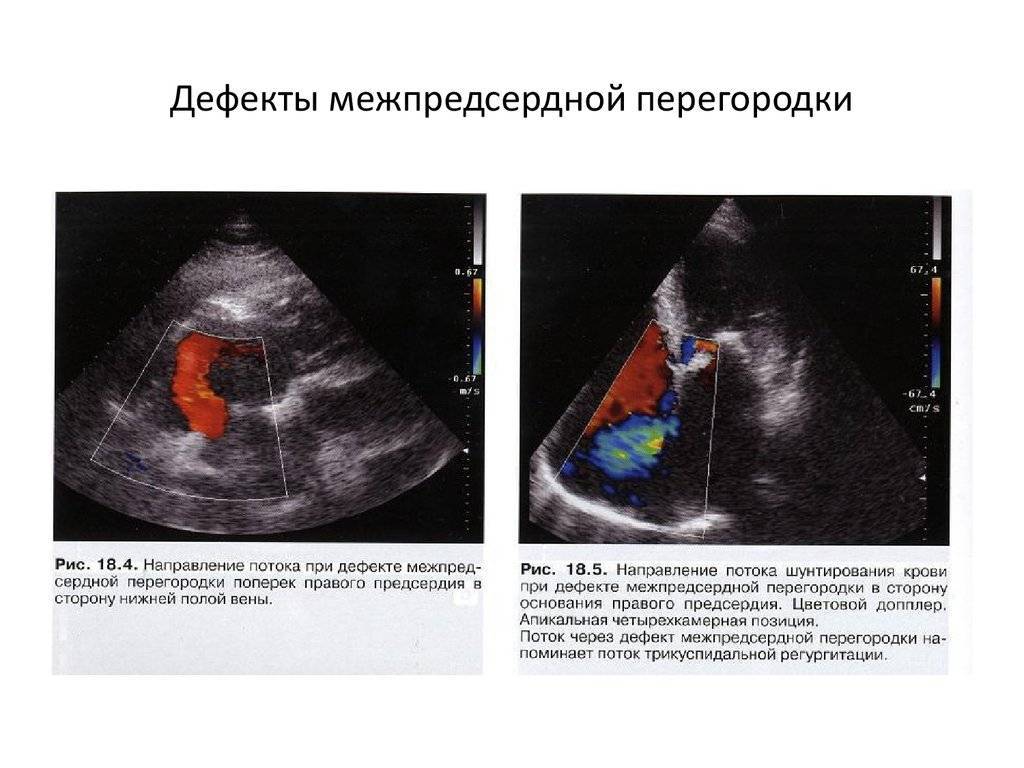
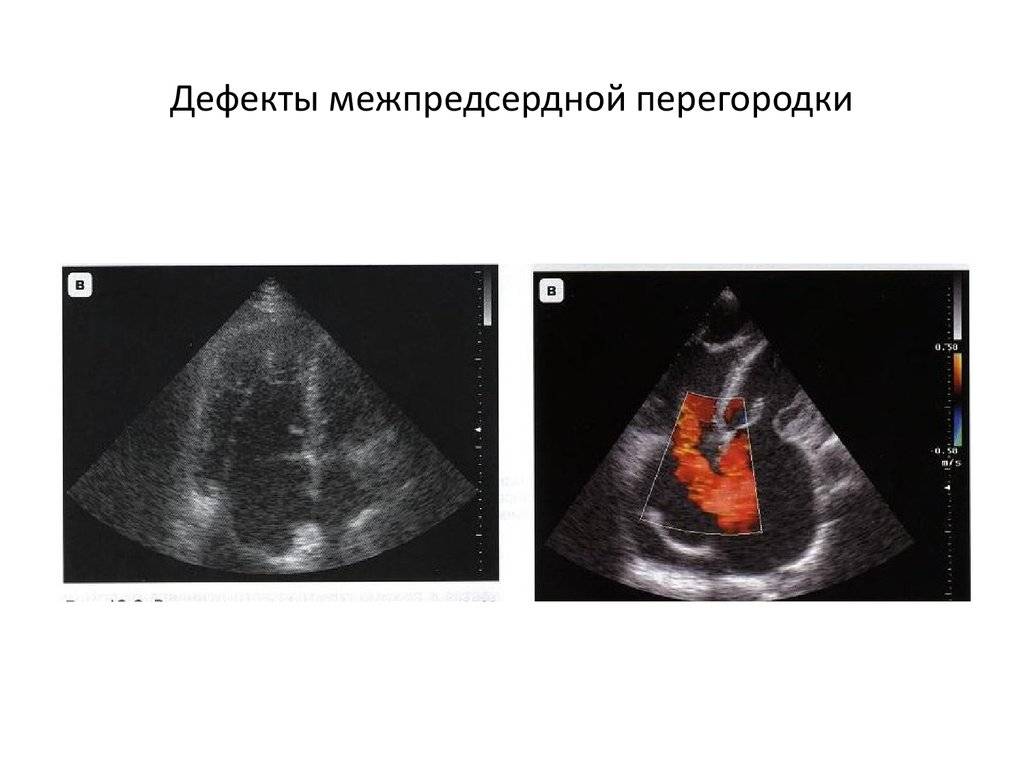
- ЭхоКГ. Визуально показывает локализацию просвета, определяет его размеры, а также левосторонний сброс кровяной массы.
- Зондирование сердечных полостей. Фиксирует повышение внутрисердечного давления в правосторонних сегментах.
- МРТ сердца. Наиболее информативная методика, способная предоставить полный объем информации о состоянии сердечно-легочной системы, если остальные диагностические методики не показали эффективности.
Лучшим вариантом исследования при врожденных дефектах строения внутренних органов служит МРТ. Без травмирования и болезненности, которые присущи стандартным эндоскопическим и зондирующим методикам, без повышенного радиационного излучения в противовес рентгену, можно сделать полноценное сканирование в любом возрасте, начиная с первых дней жизни. За один короткий сеанс врачи получат исчерпывающие данные об имеющихся нарушениях, что поможет вовремя приступить к лечению, избежать тяжелых последствия в будущем.
Виды патологии
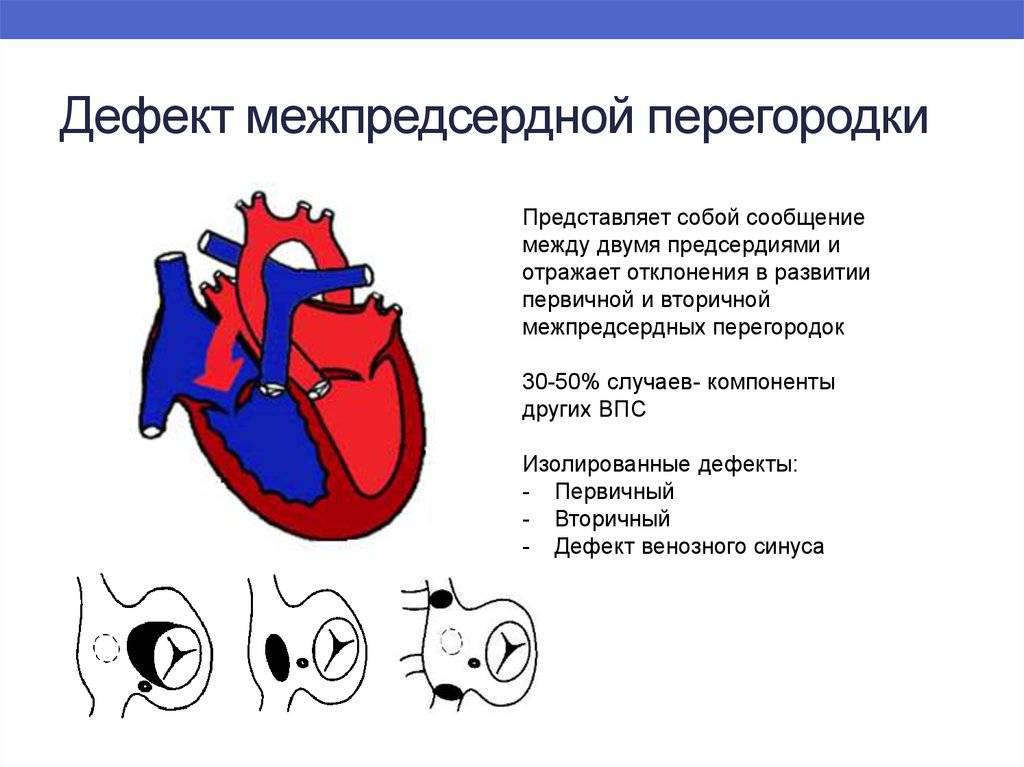
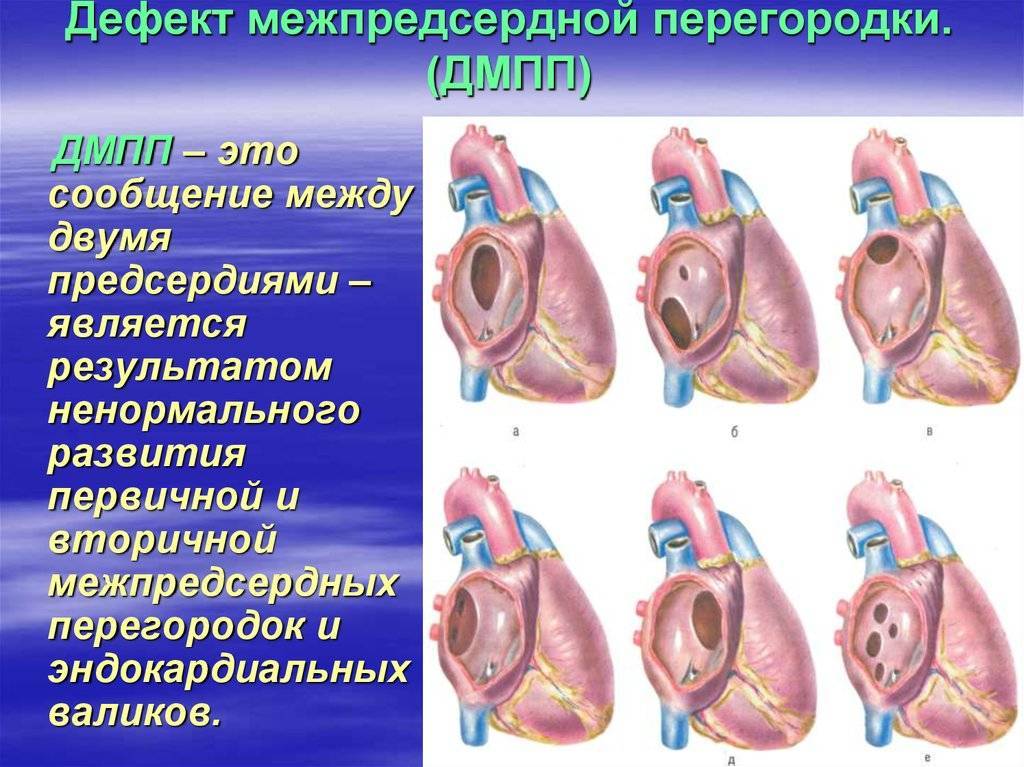
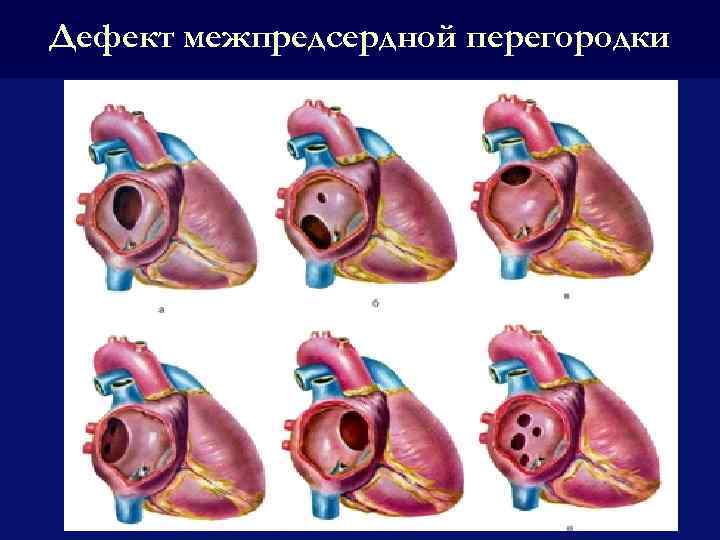
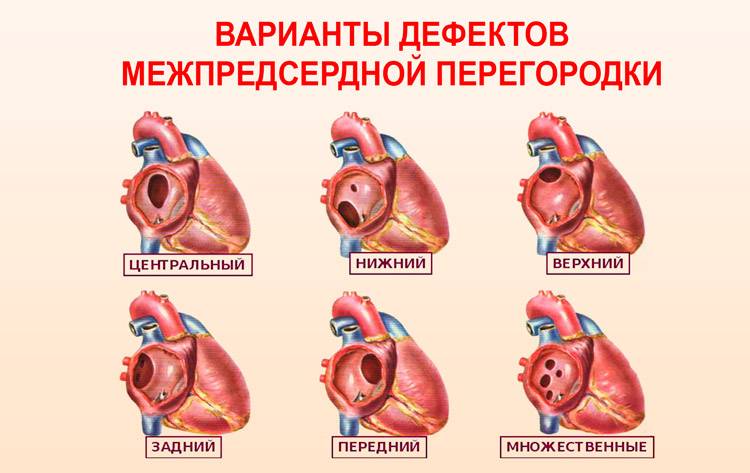
Существует разделение патологии по количественным и качественным показателям: числу, локализации и размерам перегородочных отверстий. Но самой распространенной классификацией ДМПП признано деление по характеру недоразвитости ткани:
- Первичная аномалия. Сообщение между предсердиями сохраняется на фоне недоразвития или расщепления створок, атриовентрикулярного канала. Располагается чаще в нижнем секторе, обладает большим диаметром до 5 см.
- Вторичная аномалия. Располагается чаще по центру или в венозных устьях, отличается маленькими размерами до 2 см.
- Комбинированное нарушение. Сочетаются между собой и с другими тяжелыми сердечными пороками.
- Трехкамерное сердце. Образуется, когда перегородочная пленка совсем отсутствует или максимально недоразвита. В этом случае предсердия образуют общую полость.
У новорожденных нередко диагностируют так называемое «открытое овальное окно», которое также считается патологическим сообщением между предсердиями. Связывается этот дефект с замедленным развитием сердечной ткани, но он не является истинным ДМПП, так как в большинстве случаев регрессирует самостоятельно. Ткани догоняют в развитии, просвет затягивается в течение первого месяца жизни ребенка. Если этого не происходит, требуется медицинское вмешательство.
Причины и разновидности
Патологическое отверстие формируется еще в ходе эмбрионального развития – поэтому заболевание и называется врожденный порок сердца.
Существует ряд факторов, которые могут спровоцировать рождение ребенка с пороком сердца:
- Инфекционные болезни. Особенно опасны для развития ребенка такие болезни, как краснуха, корь и ветрянка. К счастью, сейчас для женщин, которые не смогли переболеть до родов, существует вакцина.
- Курение, употребление алкоголя, прием наркотиков.
- Некоторые лекарственные препараты, например, литийсодержащие, могут спровоцировать развитие порока сердца.
- Наличие генетической предрасположенности: по статистике, один случай из двадцати объясняется наследственностью.
Если дефект небольшой, то симптомы выражены не так явно, как при крупном. Большие множественные отверстия считаются самой тяжелой формой заболевания. Если дефект состоит из мышц, то есть вероятность, что он самостоятельно затянется в течение первого года жизни – это происходит из-за общего развития мышечной стенки сердца. В остальных случаях ожидать самовыздоровления не стоит – поэтому операцию проводят как можно раньше, если это позволяет состояние ребенка.
Показания
- наличие отверстия в перегородке между желудочками сердца;
- патологический заброс крови в правый желудочек;
- повышенная нагрузка на правый желудочек;
- выраженная симптоматика.
Противопоказания
- особое расположение отверстия – близко к клапанам сердца;
- наличие некоторых других заболеваний сердца;
- непоправимые изменения в легких;
- нарушение свертываемости крови;
- острые инфекционные и воспалительные заболевания.
Дефекты типа ostium primum и открытый АВ-канал
Эти дефекты вызваны нарушением развития эндокардиальных валиков в первичном АВ-канале; самая легкая форма порока развития эндокардиальных валиков — это небольшой дефект межпредсердной перегородки типа ostium primum, а самая тяжелая — общий АВ-канал. Тяжесть и форма порока зависит от того, какие валики поражены и на какой стадии развития произошло нарушение. Поскольку эндокардиальные валики участвуют в формировании межпредсердной и межжелудочковой перегородок и обоих АВ-клапанов, пороки их развития могут приводить к самым разным нарушениям. Эти пороки могут встречаться изолированно у детей без других болезней, но часто бывают при таких врожденных синдромах, как синдром Дауна, situs ambiguus и хондроэктодермальная дисплазия (синдром Эллиса—ван Кревельда).На общее развитие плода эти пороки не влияют, но могут приводить к вторичному поражению аорты. Часто встречается легкая обструкция выносящего тракта левого желудочка, следствие которой — облигатный сброс крови слева направо и существенное нарушение гемодинамики плода. В результате у этих детей часто обнаруживается гипоплазия перешейка дуги аорты и ее коарктация.
Методы лечения ВПС
В большинстве случаев, лечение врожденных пороков сердца – хирургическое, и в зависимости от анатомии порока, определяют сроки и вид вмешательства.
В целях стабилизации состояния перед планируемым оперативным лечением прибегают к методам терапевтического медикаментозного лечения критических состояний и осложнений ВПС.
Оперативное лечение
Оперативное лечение может быть выполнено экстренно, срочно и в плановом порядке. Кроме того, оперативное лечение может быть радикальным, либо вспомогательное (т.е. проводится гемодинамическая коррекция врожденного порока).
Не занимайтесь самолечением. Обратитесь к нашим специалистам, которые правильно поставят диагноз и назначат лечение.
Оцените, насколько был полезен материал
Спасибо за оценку
Что выявляет УЗИ
В нашей клинике используется современное 4D оборудование, имеющее допплеровский режим. С его помощью можно получить изображение 3-х главных сосудов — верхней полой вены, лёгочного ствола и восходящей аорты. Во время обследования выявляется не только расположение сосудов, но и их диаметр и другие параметры.
На экране монитора будут видны следующие патологии плода:
- Уменьшение диаметра аорты при расширении лёгочного ствола можно говорить об гипоплазии (недоразвитости) левых отделов сердца малыша, отвечающих за начало кровообращения;
- Уменьшение ствола лёгочной артерии в размерах при сохранении в норме диаметров аорты и верхней полой вены указывает на стеноз (сужение) лёгочной артерии. У плода выявляются только выраженные формы;
- Маленький диаметр аорты при нормальном 4-камерном строении сердца является следствием коарктации аорты (сужение аорты сердца в определённом сегменте);
- Визуализация 2 сосудов вместо 3 может быть следствием соединения сосудов в общий артериальный ствол;
- Смещение аорты вперёд или правее лёгочной артерии наблюдается при транспозиции магистральных сосудов;
- Диаметр аорты расширен, но при этом сужен диаметр лёгочной артерии, а аорта смещена вперёд. Это может является тетрадой Фалло (очень тяжёлая сочетанная аномалия сердца). Проблема включает в себя стеноз или гипертрофию выходного отдела правого желудочка, дефект межжелудочковой перегородки, декстропозицию аорты (отхождение в правую сторону). Диагностика плода крайне затруднительна, поэтому на помощь приходит допплеровский режим, помогающий визуализировать поток крови в аорту из обоих желудочков;
- Гипоплазия (недоразвитость) правых камер сердца определяется по уменьшению их размеров относительно левых камер. Эта патология сопровождается обычно дисплазией (провисанием или выбуханием) митрального клапана;
- Общий предсердно-желудочковый канал виден как дефект перегородки сердца с расщеплением атриовентрикулярного клапана;
- Гипопластический синдром левых отделов сердца проявляется в виде недоразвития желудочка и митрального и аортального клапанов;
- Единственный желудочек также не является нормой, потому что их должно быть два и они хорошо просматриваются в четырёхкамерном срезе;
- При недоразвитости трёхстворчатого клапана кровь из правого предсердия не попадает в левое, что хорошо видно при допплеровском исследовании;
- Со 2 триместра фиброэластоз эндокарда визуализируется как утолщение миокарда и ухудшении его сокращения;
- Недоразвитие миокарда одного из желудочков (аномалия Уля) заметна на 2 триместре.
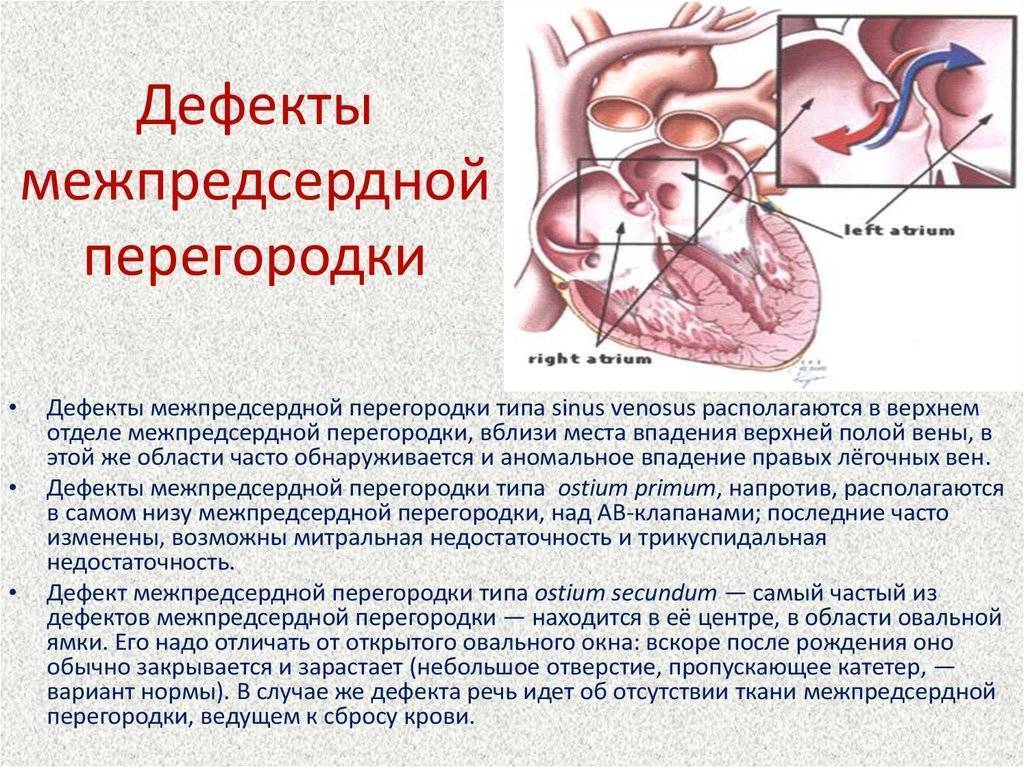
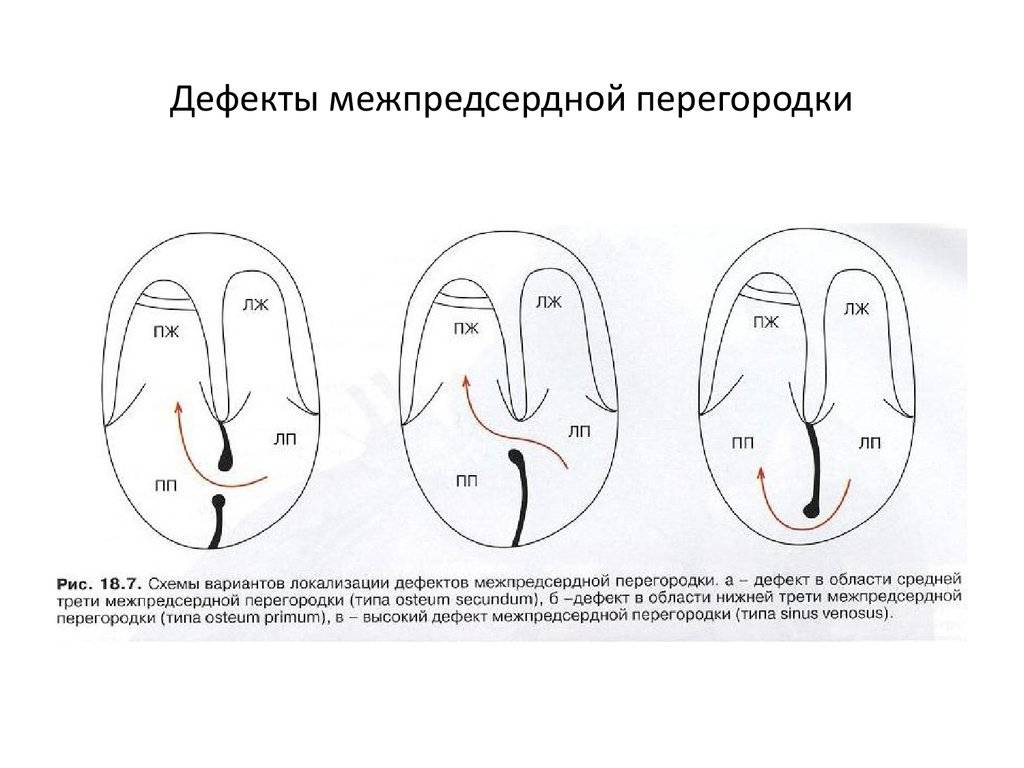
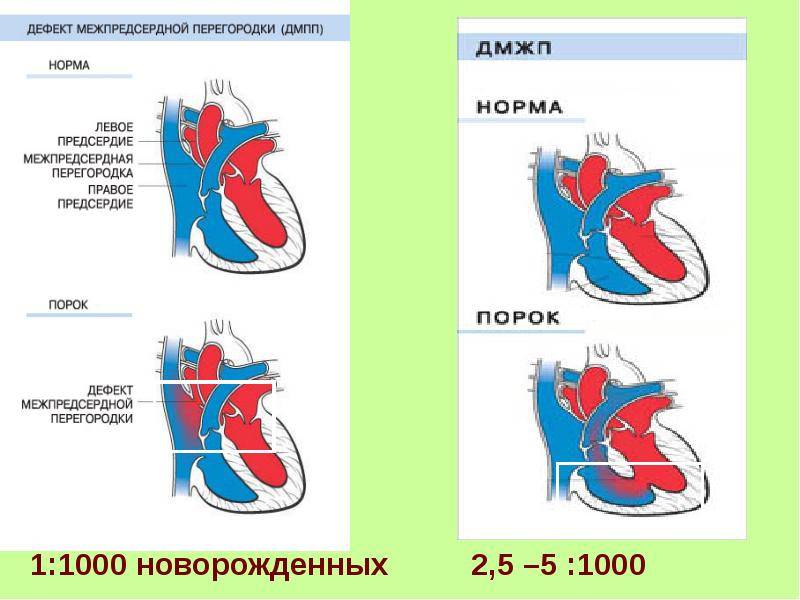
Что такое первичный дефект межпредсердной перегородки?
К первичным относят дефекты, при которых отверстие расположено в нижней части межпредсердной перегородки, так что оно граничит с предсердно-желудочковыми клапанами.
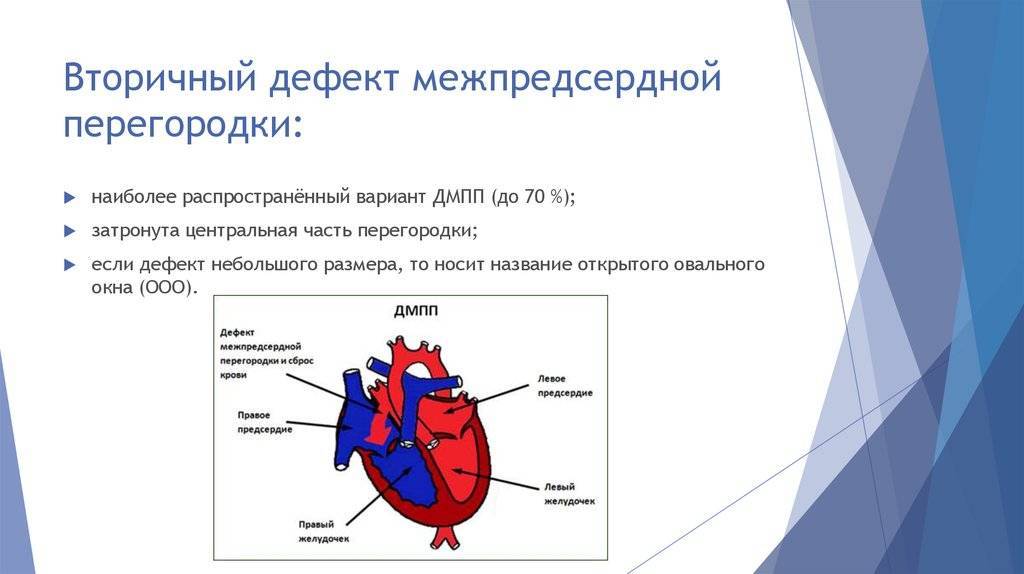
Вторичный дефект межпредсердной перегородки называют отверстие в ней, если оно находится в ее средней и/или верхней частях.
Первичный дефект межпредсердной перегородки в изолированном виде встречается очень редко.
Дефекты межпредсердной перегородки могут самостоятельно закрываться у детей в течение первого года жизни, что наблюдается примерно у 16% пациентов с такими пороками.
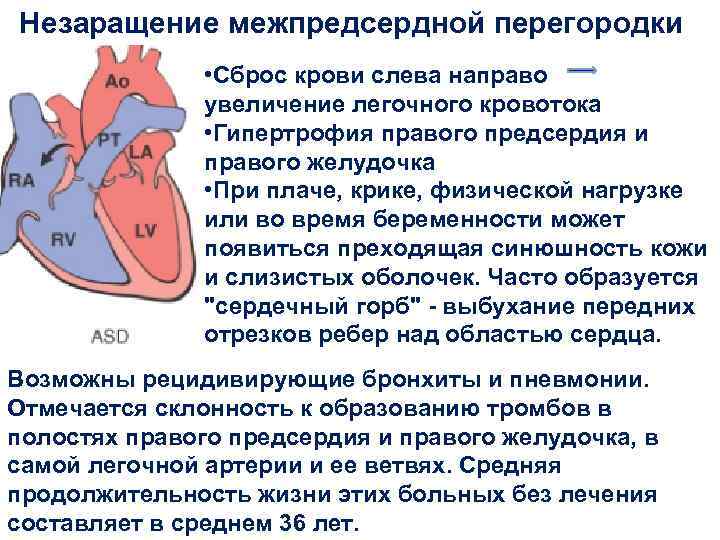
Клиническая картина дефектов ДМПП складывается из симптомов перегрузки правых отделов сердца, поскольку в правом предсердии постоянно находится слишком большое количество крови. Но компенсаторные возможности сердечно-сосудичстой системы довольно велики, так что только один из ста детей с пороком межпредсердной перегородки проявляет признаки заболевания в первые месяцы жизни.
Как правило, основные жалобы начинаются лишь в старшем подростковом возрасте, в 15-17 лет. До этого периода у детей отмечаются только одышка, сильное сердцебиение и повышенная утомляемость.
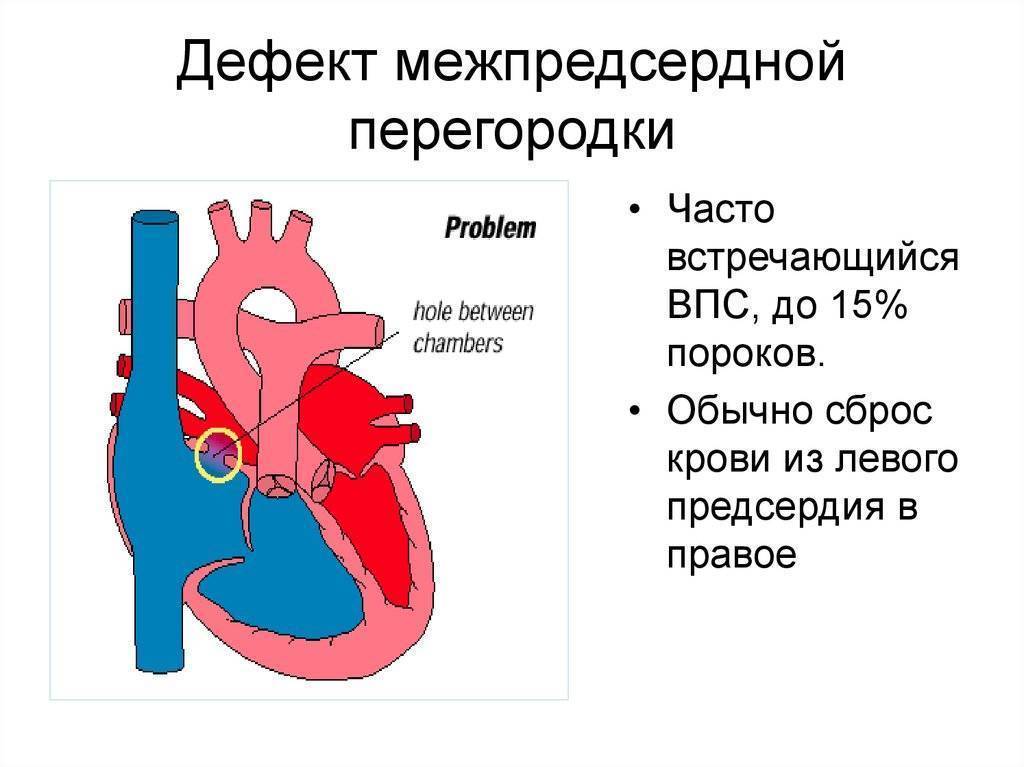
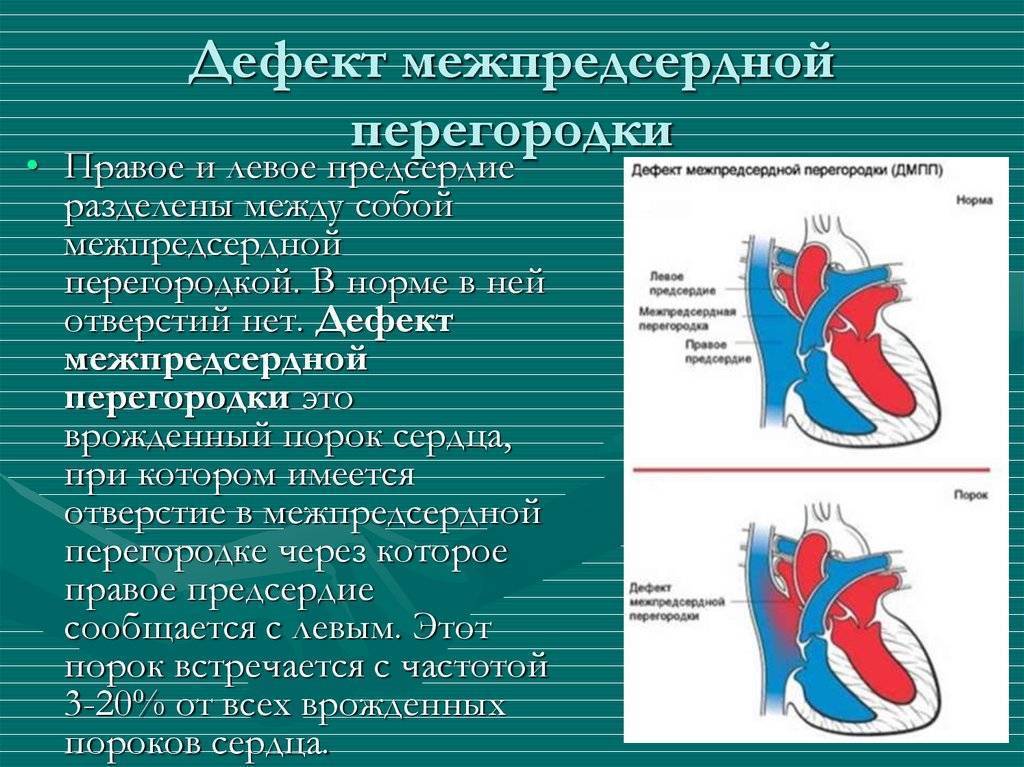
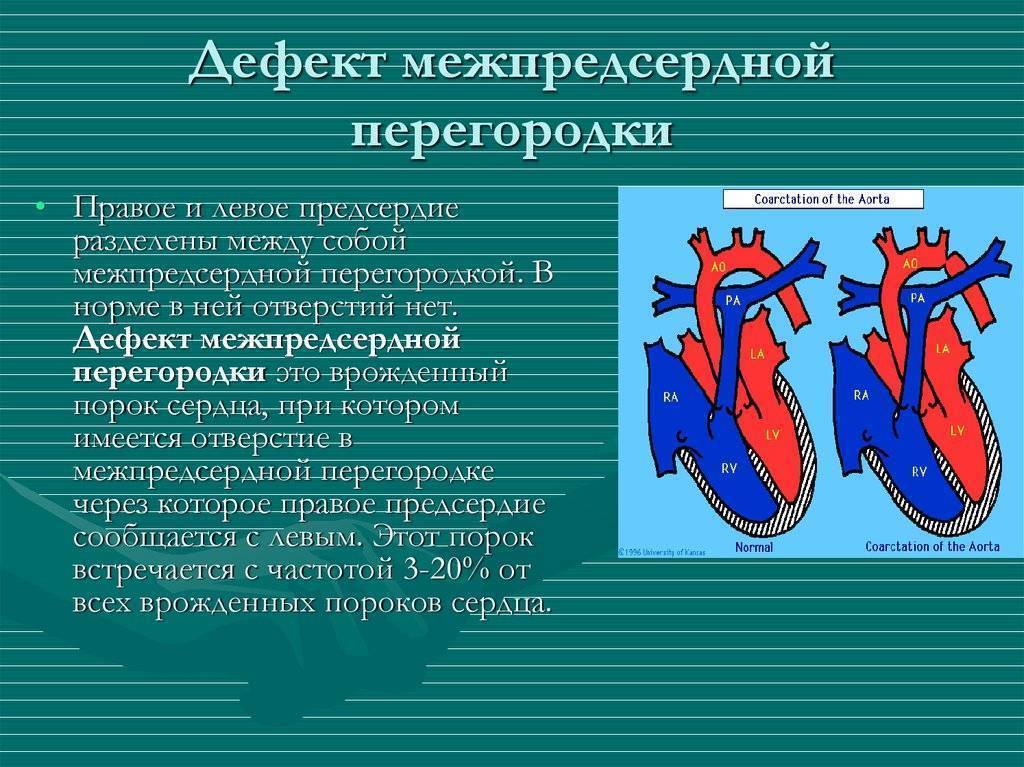
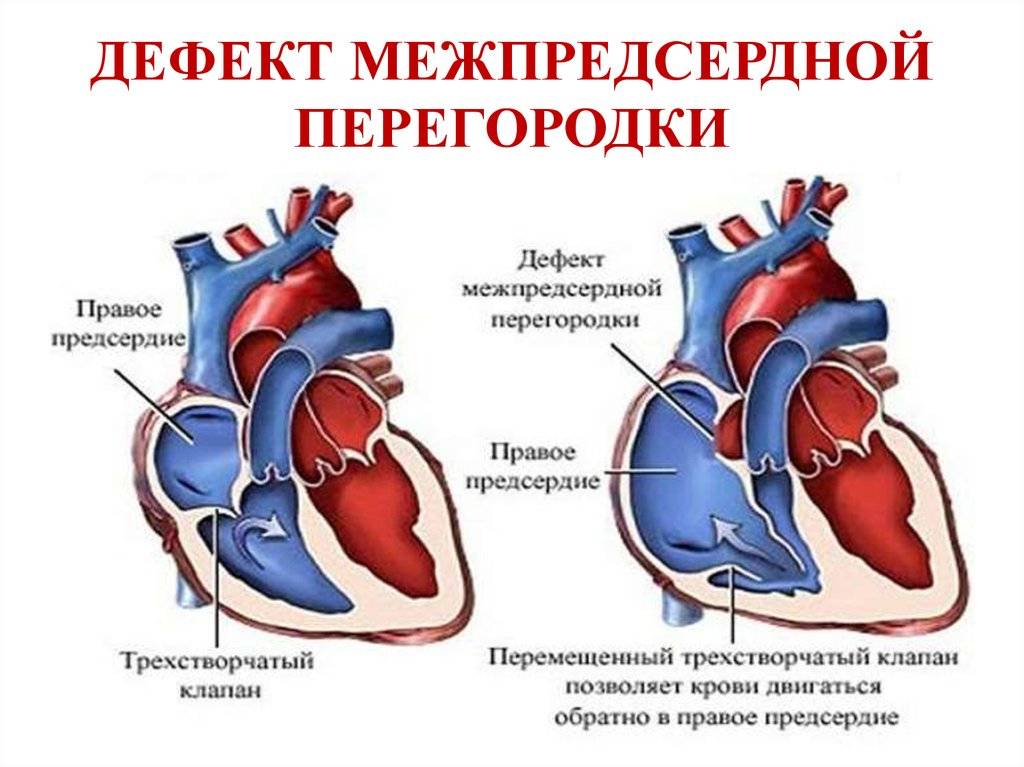
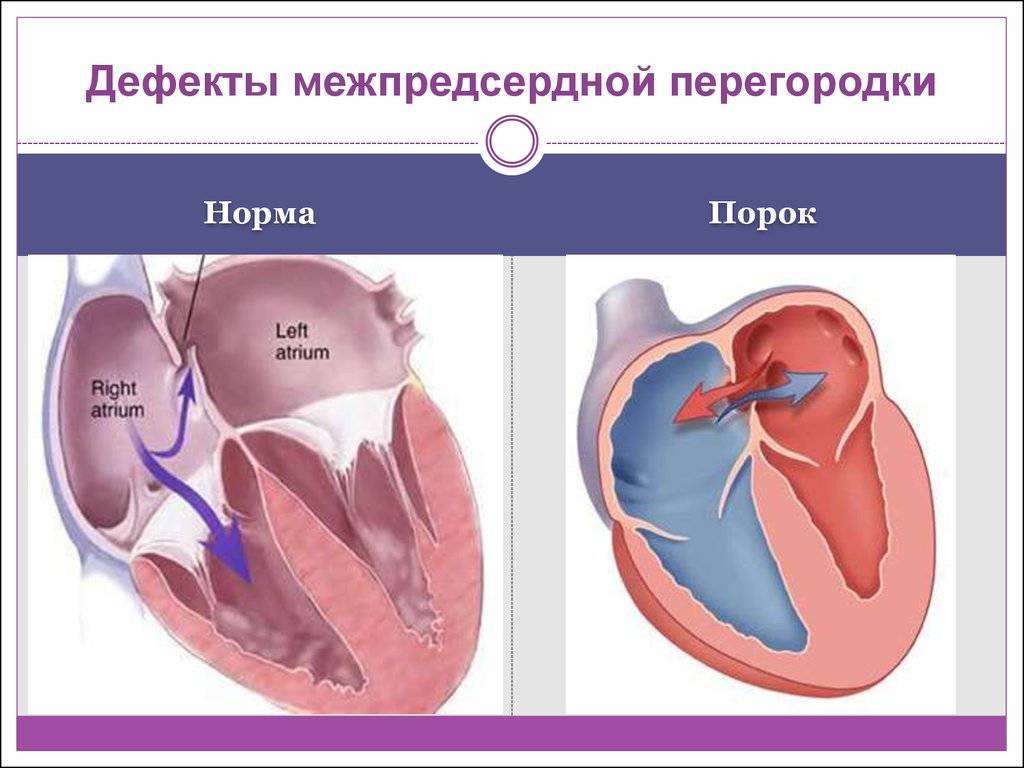
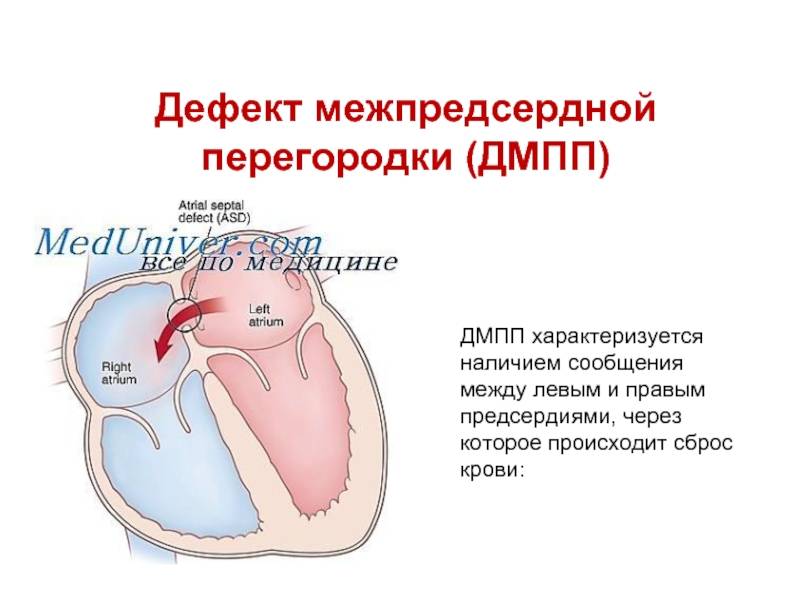
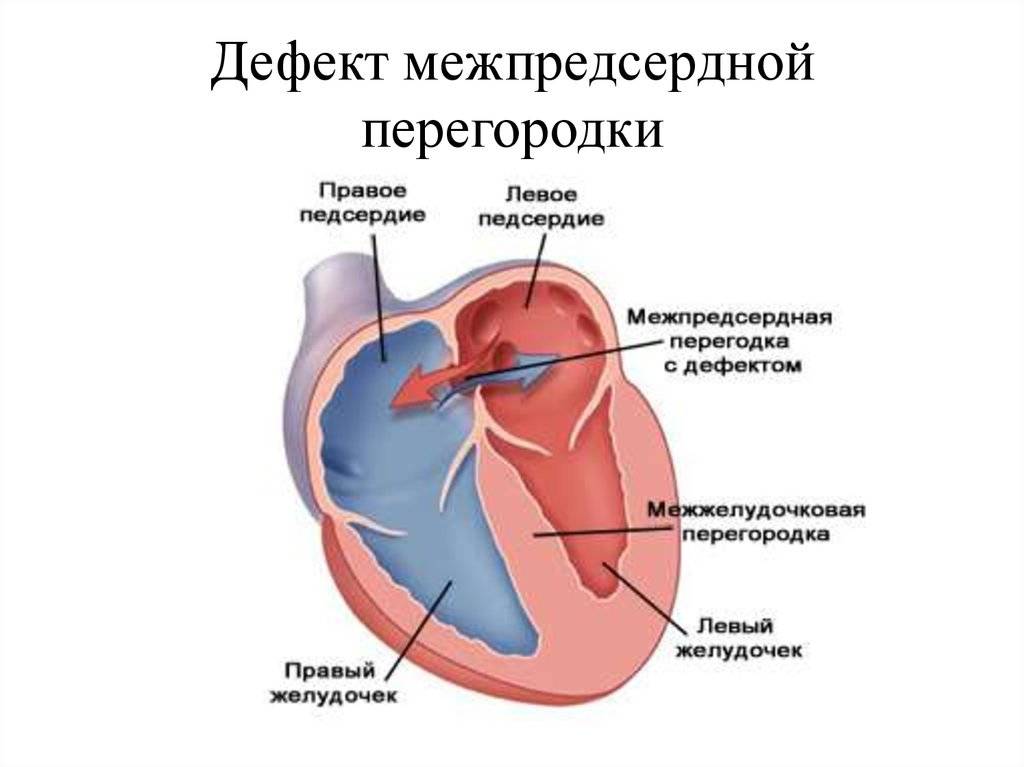
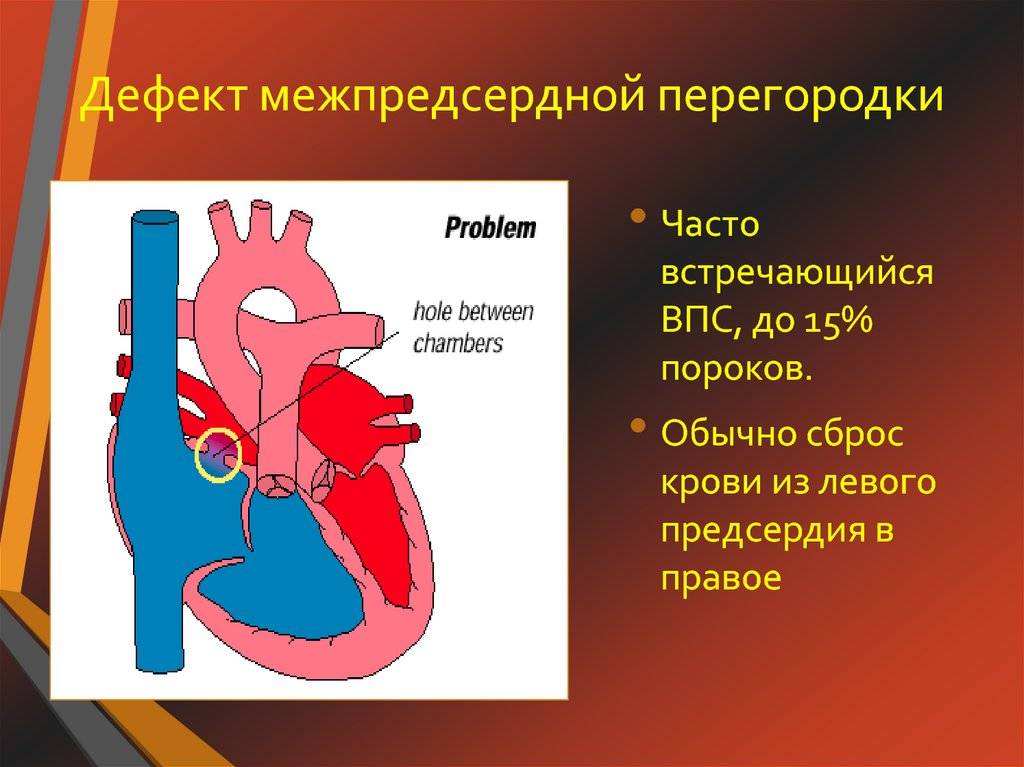
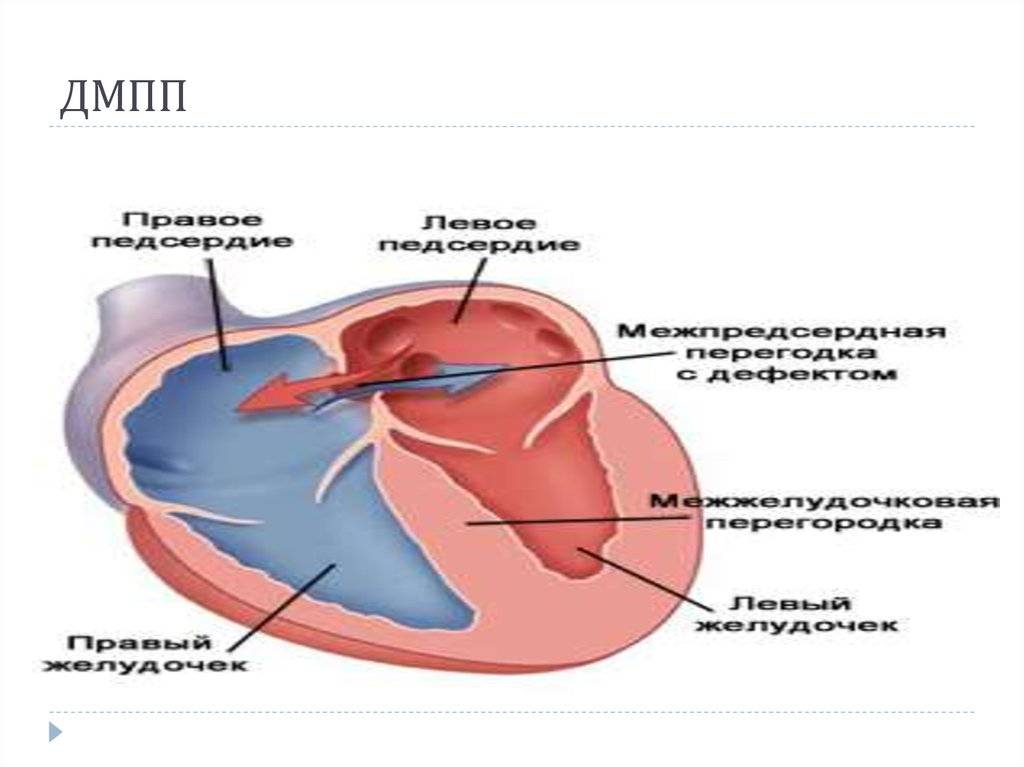
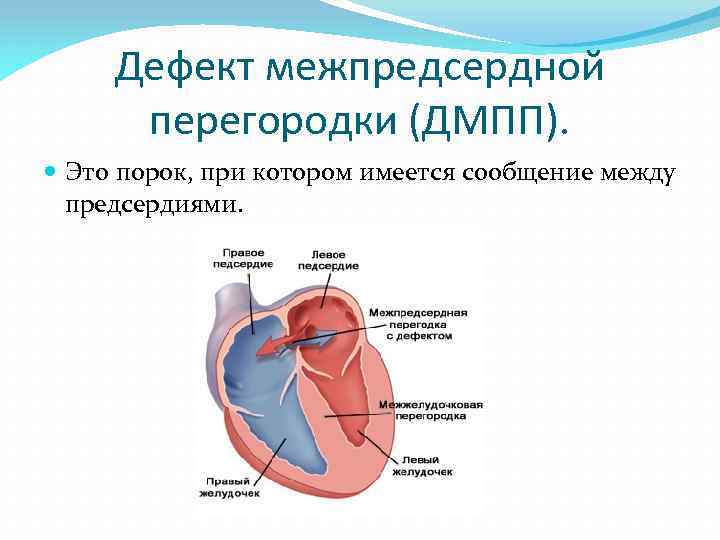
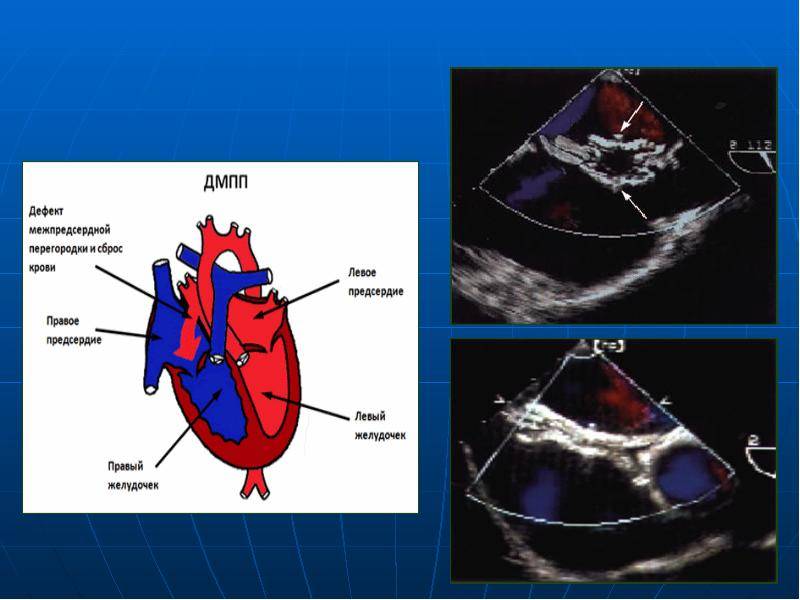
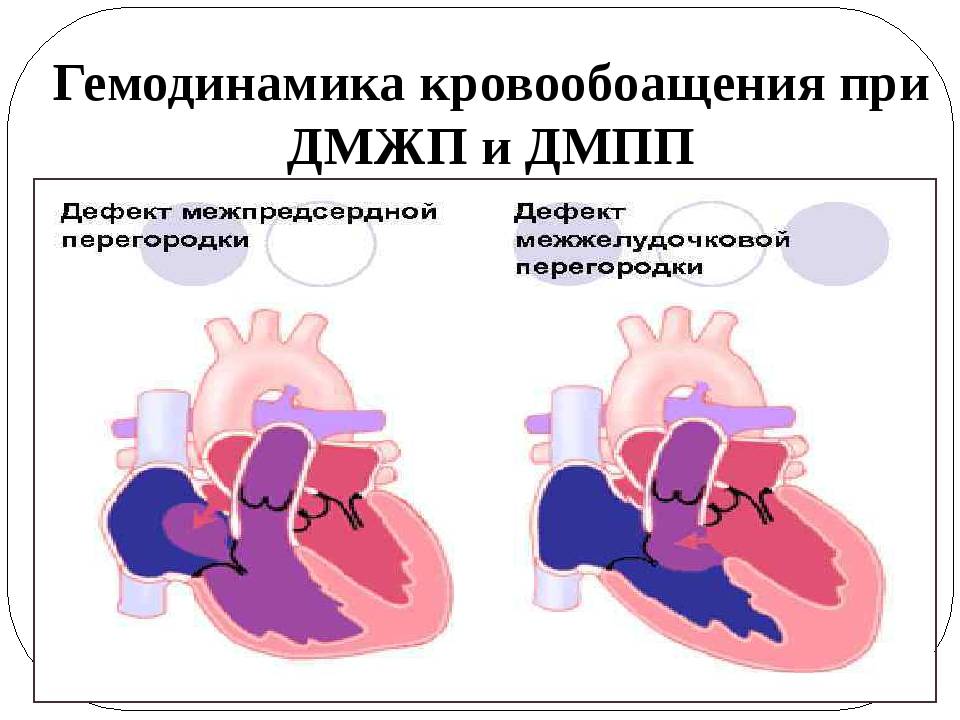
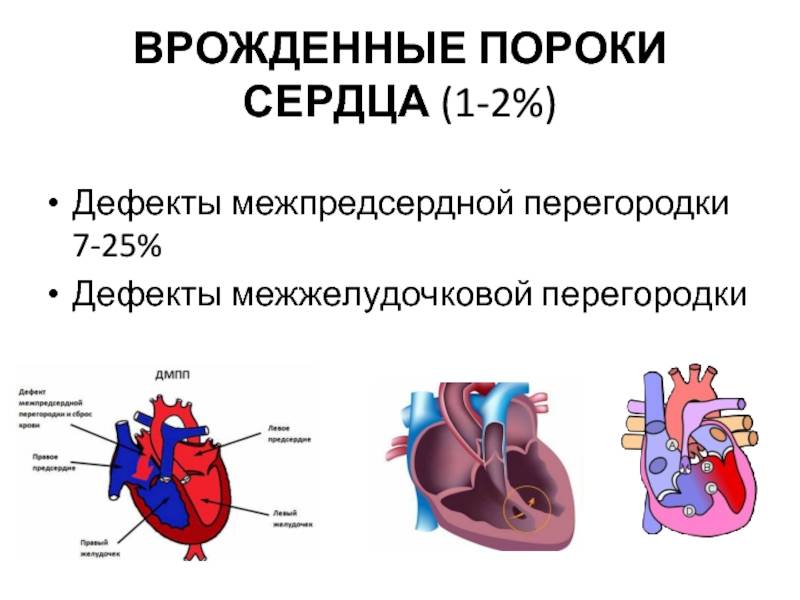
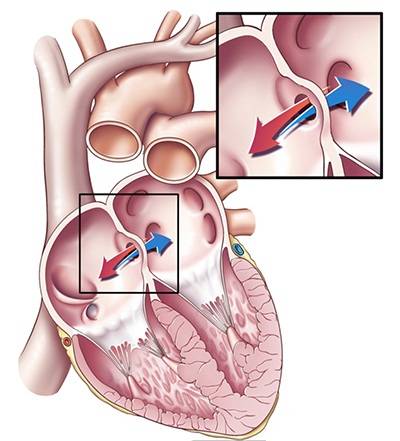
Дефекты межпредсердной перегородки (ДМПП)
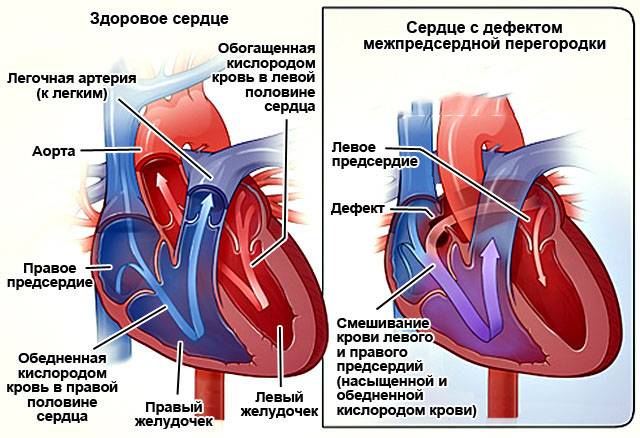
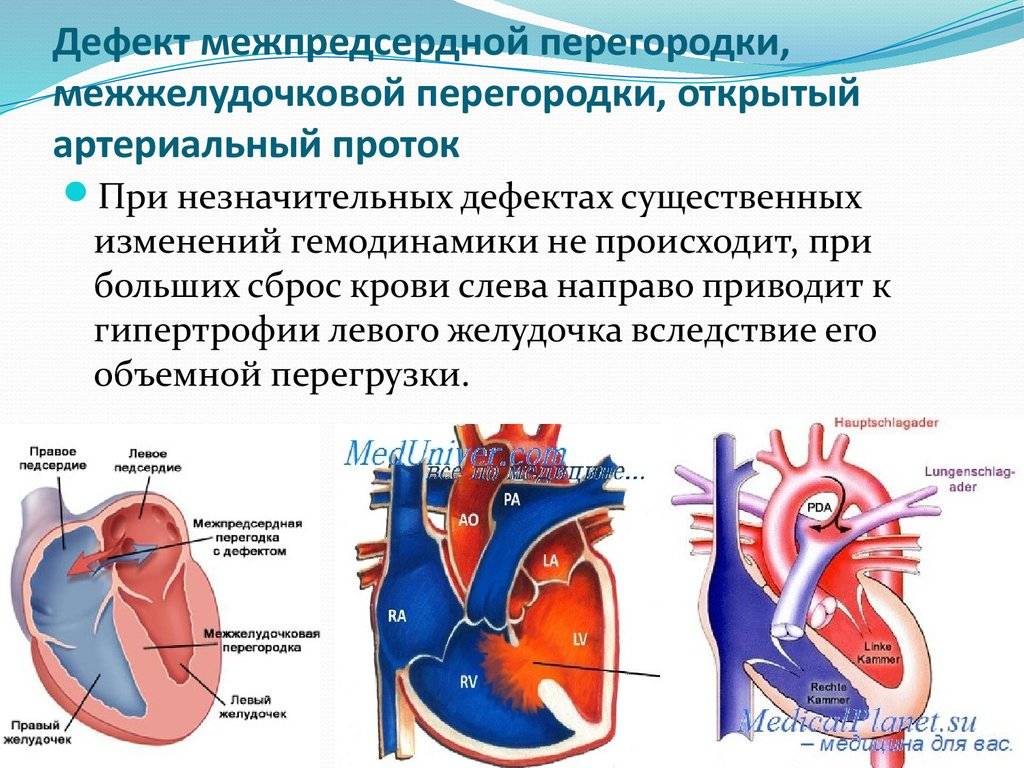
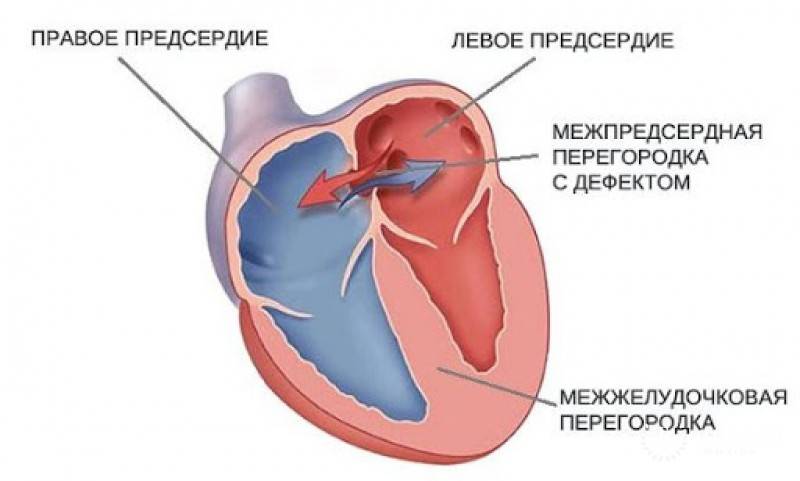
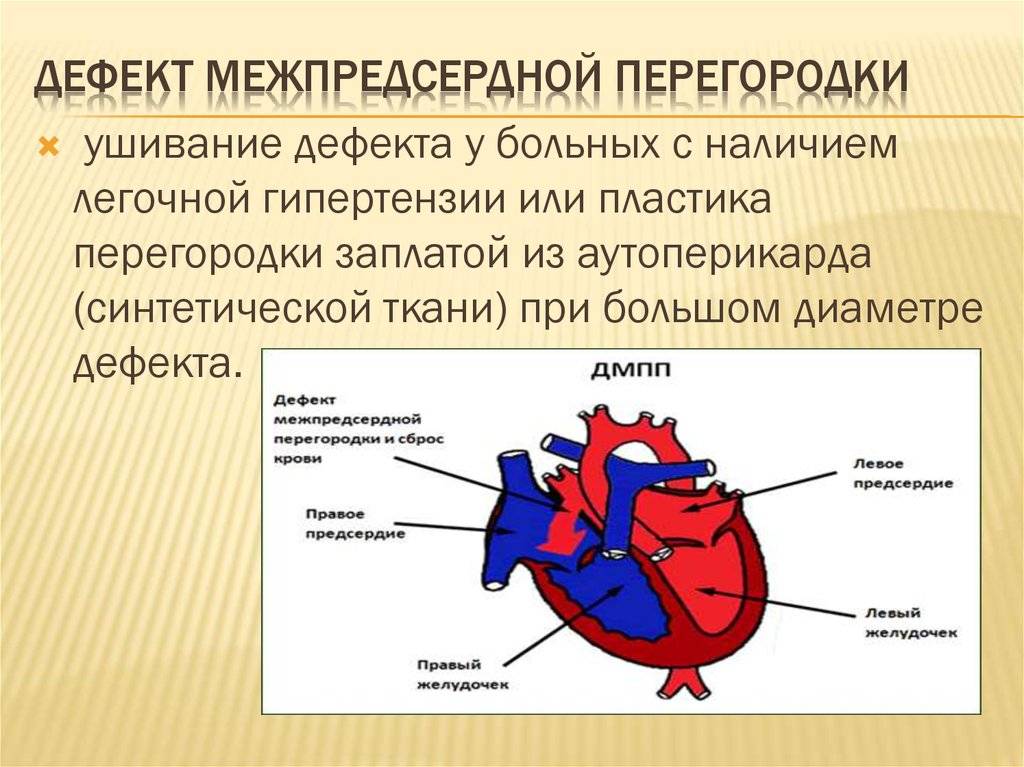
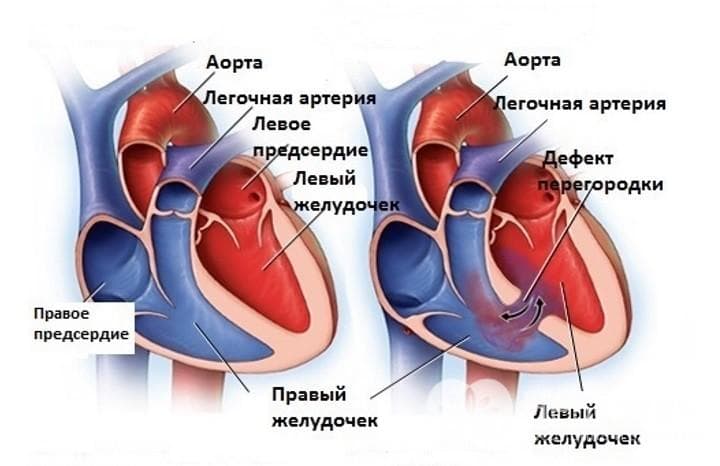
Недоразвитие межпредсердной перегородки может привести к образованию дефекта межпредсердной перегородки (ДМПП) — открытого отверстия между правым и левым предсердиями. В результате этого кровь из левого предсердия под более высоким давлением попадает в правое предсердие и далее в правый желудочек и легкие.
По расположению различают несколько видов дефектов межпредсердной перегородки:
- «Вторичный (центральный) ДМПП» является самым частым и встречается в 80% случаев.
- «Первичный ДМПП» встречается в 15% случаев.
- На остальные формы ДМПП приходится менее 5%.
Диаметр ДМПП варьируется от 3 мм. до 3 см. и более.
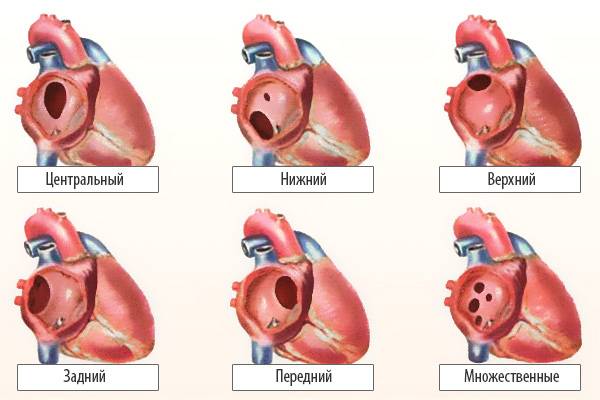 Варианты дефектов межпредсердной перегородки
Варианты дефектов межпредсердной перегородки
80% дефектов у новорожденных закрываются к возрасту 18 месяцев. В 20% случаев дефект сохраняется, при этом показанием к закрытию ДМПП у детей является отверстие более 8 мм., наличие сердечной недостаточности, незаращение дефекта к возрасту 4 лет.
Зачастую дефект межпредсердной пререгородки протекает бессимптомно и не ограничивает жизнь человека на протяжении многих лет, вследствие чего остаётся не диагностированным.
У 70% пациентов не выявленный в детстве ДМПП начинает проявляться в возрасте от 18 до 40 лет.
Проявлениями ДМПП со временем становятся:
- повышенная физическая утомляемость;
- появление одышки при повседневных нагрузках;
- пароксизмы учащенного неритмичного сердцебиения (суправентрикулярная тахикардия, трепетание и фибрилляция предсердий);
- повышенная частота инфекционных заболеваний дыхательной системы;
- отеки нижних конечностей.
Часто пациенты не подозревают о наличии у них ДМПП и диагноз устанавливается неожиданно при плановом выполнении ЭХО-КГ.
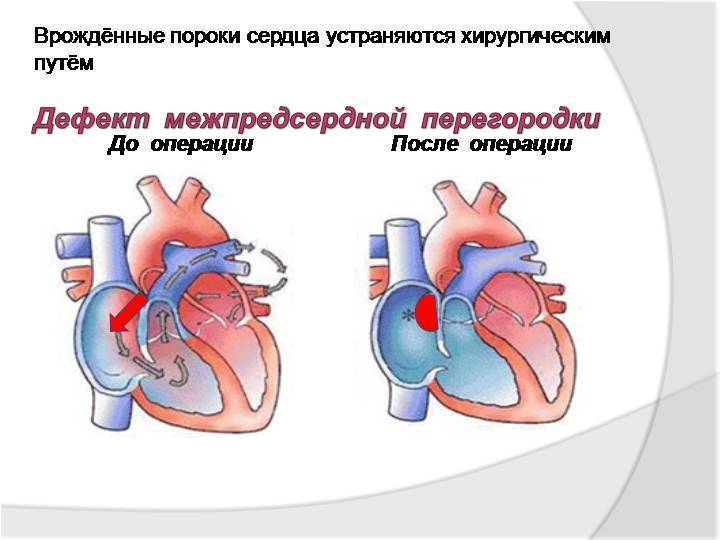
Целью закрытия дефекта межпредсердной пререгородки является снижение повышенной нагрузки на сердце и легкие, предотвращение сердечно-легочной недостаточности и последующих необратимых морфологических изменений тканей сердца и лёгких. Чем раньше ДМПП будет устранён, тем выше вероятность полного восстановления морфологии сердца и лёгких, и ниже вероятность развития осложнений из-за длительной их перегрузки.
Наилучшие результаты лечения проявляются при закрытии дефекта у пациентов до 25 лет. Операции проведённые у пациентов старше 40 лет улучшают качество жизни, увеличивают переносимость физических нагрузок, уменьшают проявления одышки. Однако, у данной возрастной группы в результате длительного наличия ДМПП часто развиваются нарушения ритма сердца в результате стойких изменений стенки предсердий: тахикардия, трепетание и фибрилляция предсердий. Таким пациентам после закрытия дефекта необходимо рассмотрение вопроса о выполнении радиочастотной аблации для восстановления нормального сердечного ритма.
Общая информация
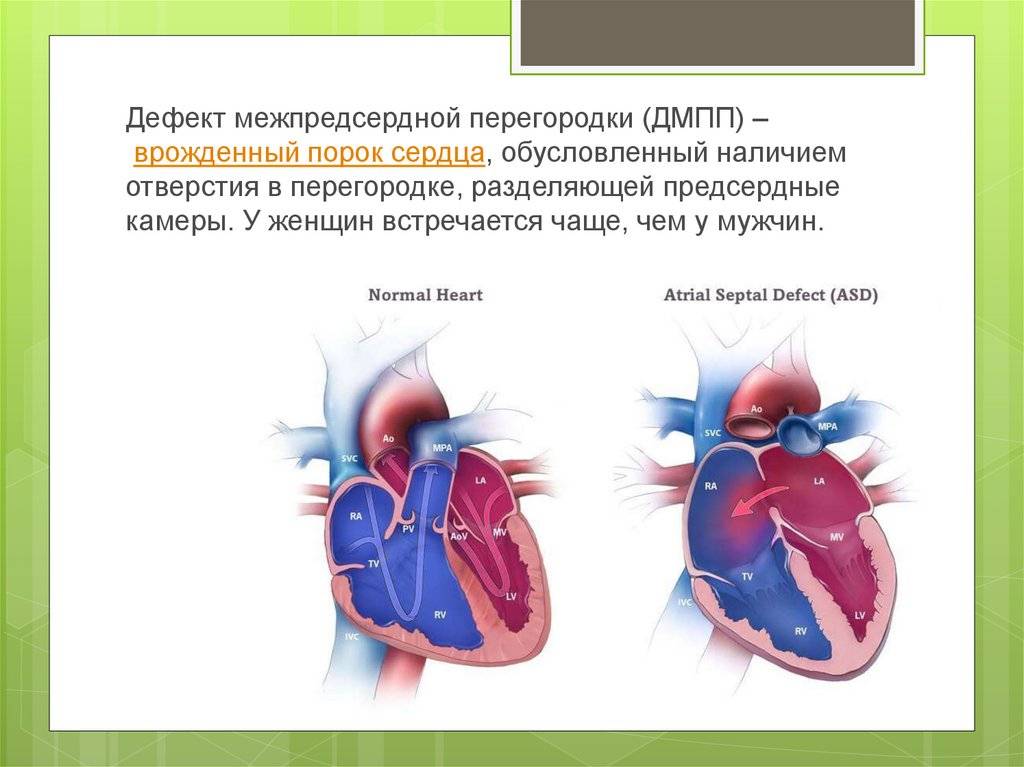
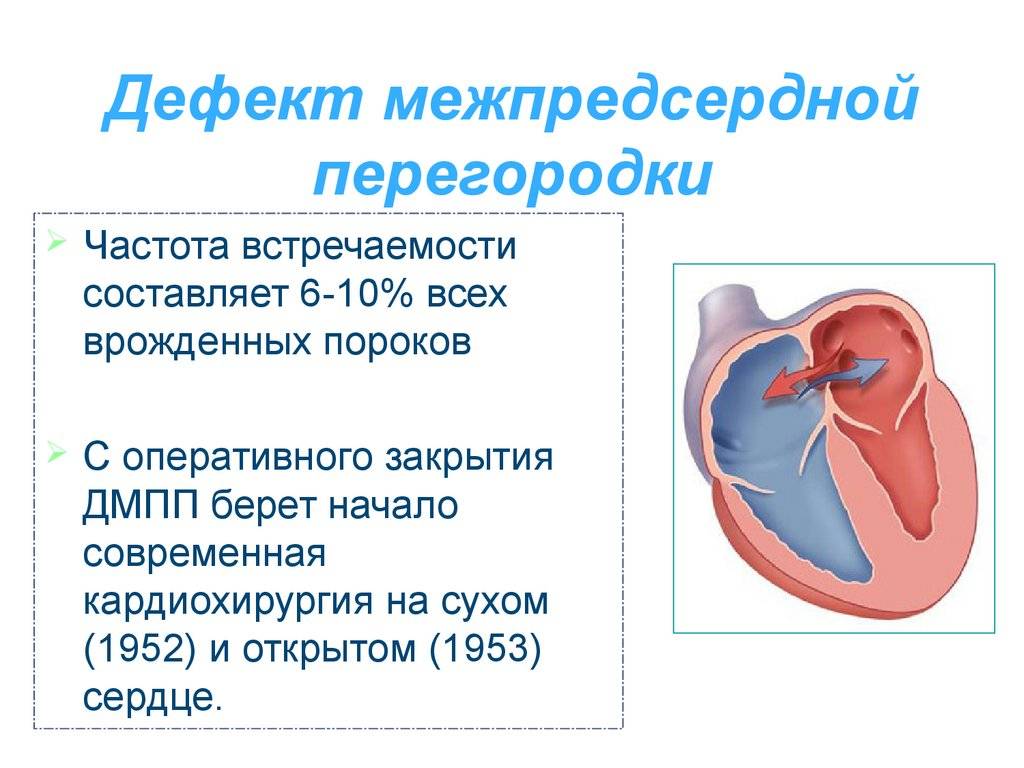
Дефект межпредсердной пререгородки (ДМПП) — самый часто встречающийся врожденный порок сердца у взрослых, находится на втором месте по частоте развития у детей.
Дефект межпредсердной пререгородки (ДМПП)
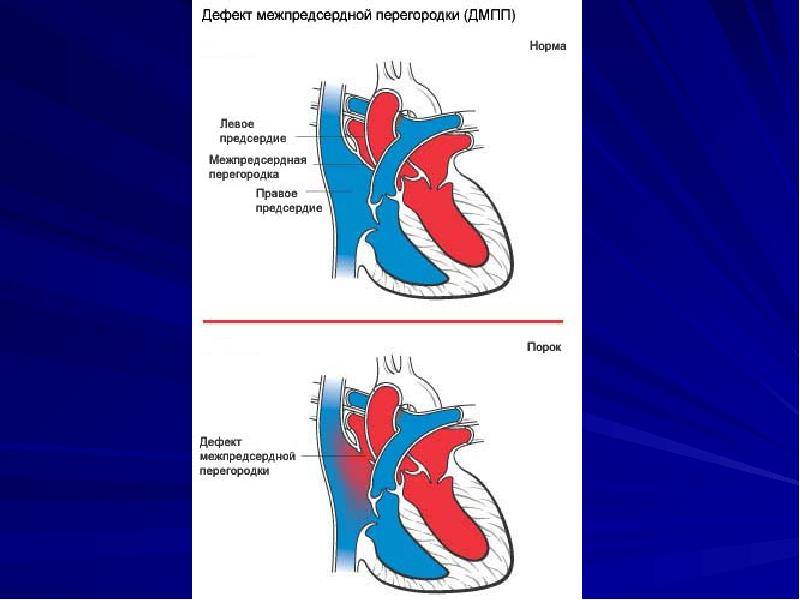
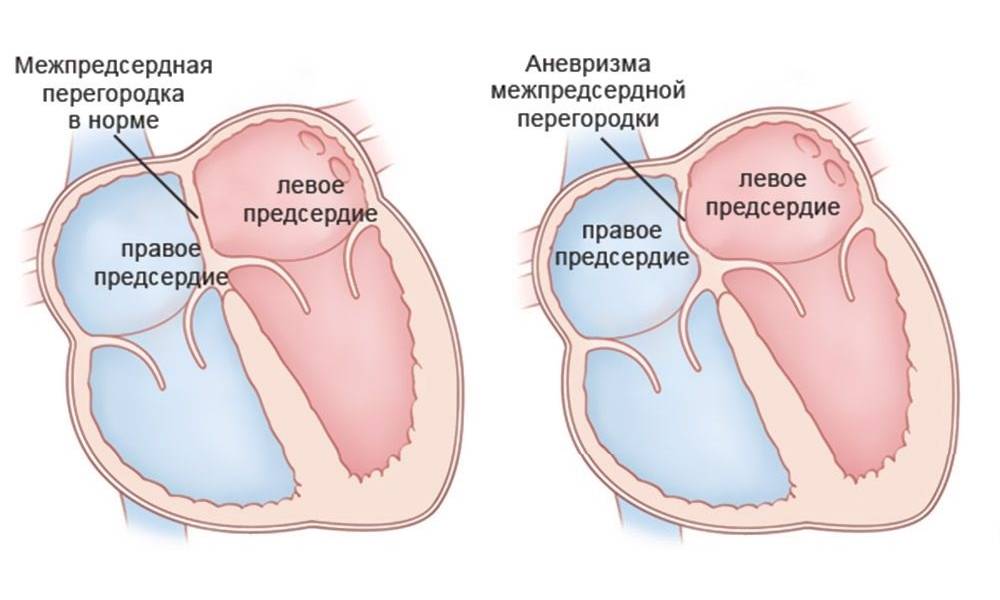
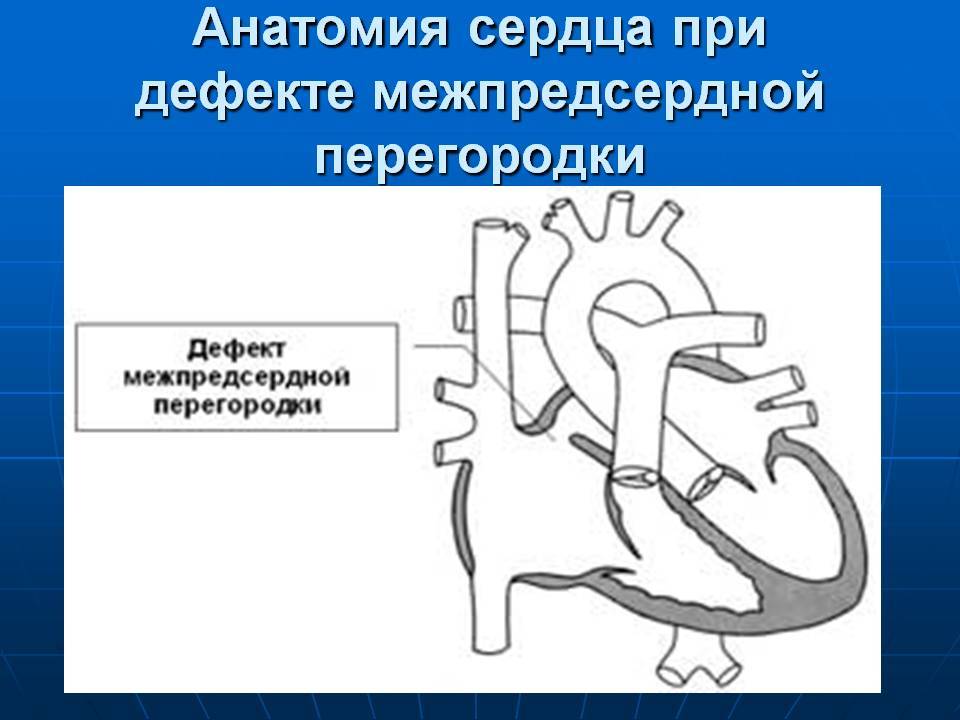
Деление единого общего предсердия на две части, правую и левую, начинается уже к пятой неделе развития плода внутри утробы матери. В последующем начинает появляться межпредсердная перегородка, которая развивается из двух частей. Сначала — первичная перегородка, а затем — вторичная перегородка. Перегородки располагаются параллельно и плотно друг к другу. До рождения между предсердиями функционирует физиологическое сообщение — щель между первичной и вторичной перегородками, прикрытая гибкой створкой — это так называемое «овальное окно».
Овальное окно
Проходимость «овального окна» осуществляется вследствие того, что давление в правом предсердии выше и кровь из правого предсердия попадает в левое. Сообщение между предсердиями необходимо, так как у плода не функционируют легкие. После рождения, когда новорожденный начинает дышать, давление в правом предсердии падает и гибкая створка закрывает щель между предсердиями, это происходит в 70% случаев. В 30% «случаев овальное» окно остаётся открытым и в подавляющем большинстве случаев закрывается в течение двух лет после рождения. В редких случаях открытое «овальное окно» может сохраняться в течение всей жизни, обычно не влияет на работу сердца и крайне редко нуждается в закрытии.
Овальное окно и закрытие его с помощью окклюдера
Аневризма мембранозной части межжелудочковой перегородки
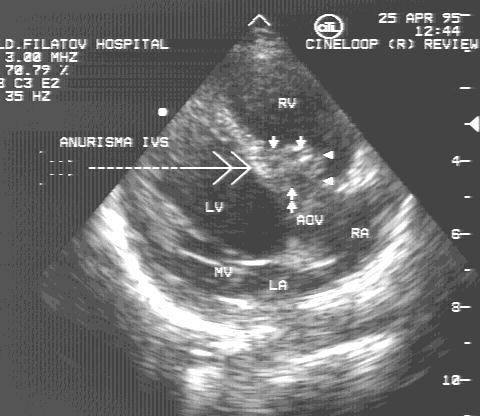
Рис.86.
ДМЖП. Аневризма
мембранозной части
межжелудочковой
перегородки.
Может быть изолированной или сочетаться с другими ВПС
(ДМЖП, аортальная недостаточость, коарктация аорты, открытый артериальный
проток), а также возникает после спонтанного закрытия дефекта.
Одномерная ЭхоКГ:
- Дополнительные эхосигналы в выходном тракте правого
желудочка от межжелудочковой перегородки в систолу, исчезающие в диастолу.
При аневризме образовавшейся после спонтанного закрытия ДМЖП дополнительные
эхосигналы определяются в полости правого желудочка. - Нарушение переднего (аортосептального) продолжения.
- Диастолическое трепетание передней створки митрального
клапана.
Двухмерная ЭхоКГ:
- Выбухание контура перегородки в сторону правого
желудочка усиливающееся в систолу. - Истончение стенки перегородки в области аневризмы.
- Изменение кинетики септальной створки трикуспидального
клапана (аневризма обычно находится под септальной створкой). - Выявление сопутствующих врожденных аномалий.
Допплер ЭхоКГ:
- Определение или исключение лево-правого сброса в области аневризмы.
- Оценка функции трикуспидального клапана (относительная
недостаточность клапана наблюдается в 60% случаев). - Выявление обструкции выходного тракта правого желудочка.
- Выявление сопутствующих внутрисердечных аномалий.
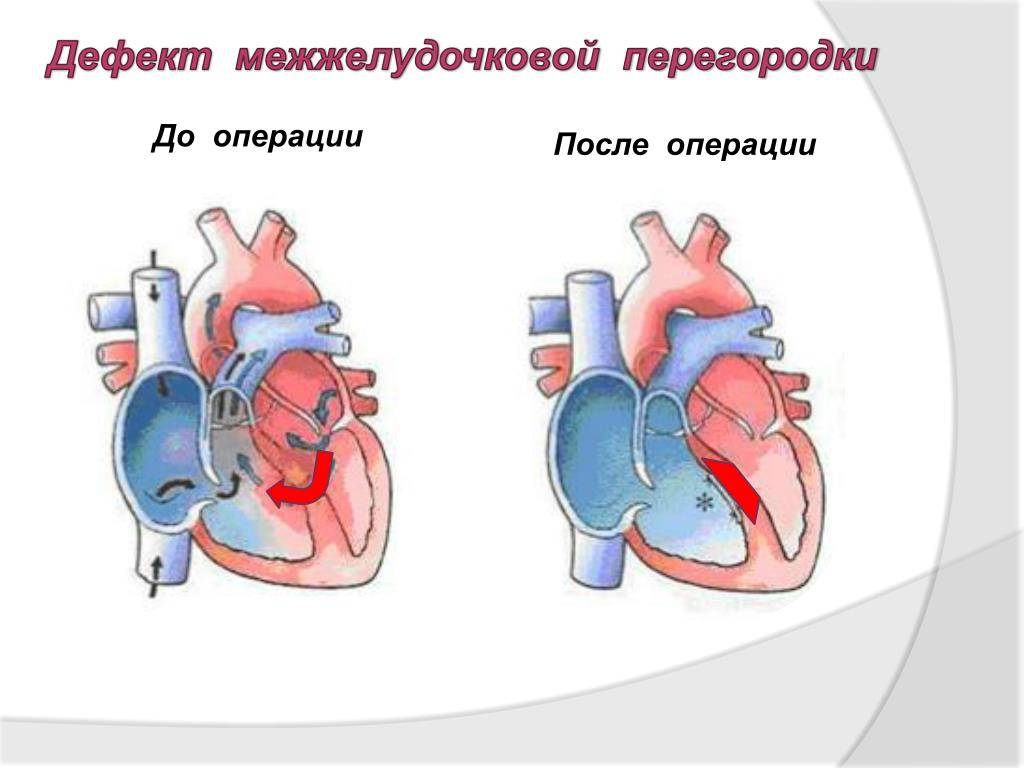
Лечение дефекта
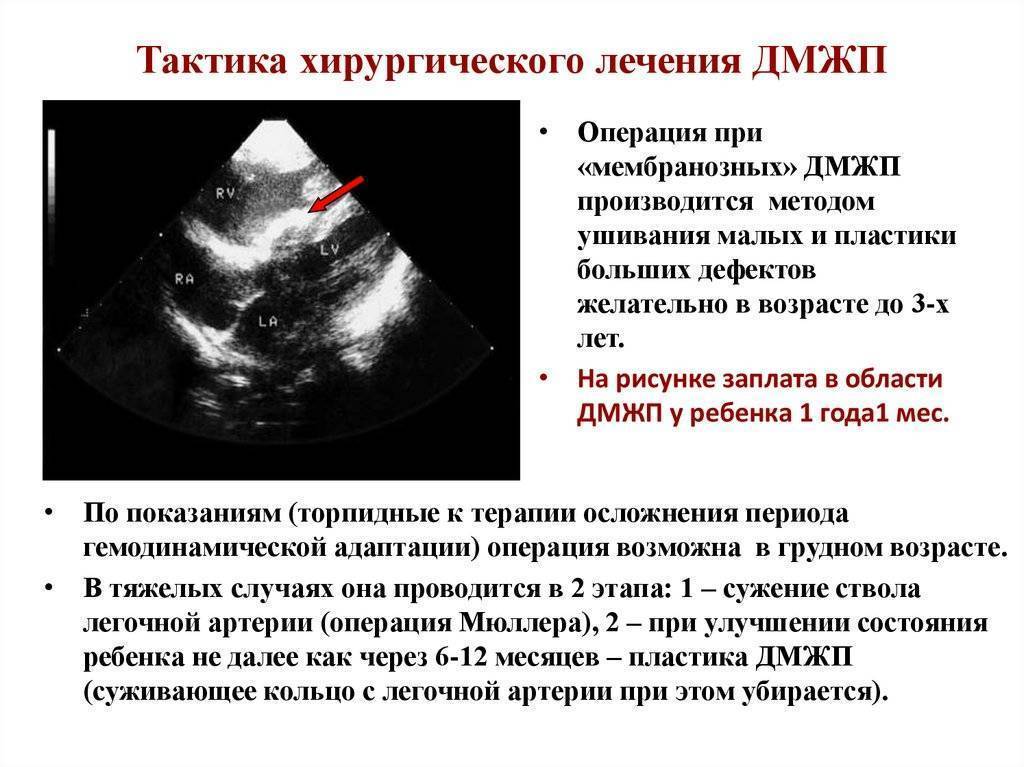
Лечение не требуется в двух случаях: если дефект состоит из мышечной ткани (вне зависимости от размера и локализации от него можно ожидать самостоятельного закрытия), а также, если отверстие небольшое, а ребенку не более двух лет. Маленькие повреждения могут затягиваться в раннем детском возрасте – поэтому требуется только наблюдение.
Остальным пациентам необходима специфическая операция – закрытие дефекта межжелудочковой перегородки. Несмотря на то, что процедуру стараются провести как можно раньше, иногда требуется выждать некоторое время. В таком случае назначают поддерживающую медикаментозную терапию, призванную снизить нагрузку на сердечную мышцу и поддержать сосуды. Существует два принципиально разных подхода к хирургии: эндоваскулярное лечение и открытая операция. Последний вариант сложный технически – требуется специальное оборудование для поддержания искусственного кровообращения, а реабилитационный период может протекать с осложнениями.
Факторы развития
Заболевание встречается, как самостоятельная патология, так и совмещенная с иными дефектами развития органа. Нарушения появляются уже в эмбриональном периоде, когда происходит формирование системы кровообращения в первом триместре беременности матери. Повлиять на естественный механизм нормального развития способны любые неблагоприятные факторы внешней и внутренней природы:
- генетическая предрасположенность, семейственность сердечных пороков, наличие старших родственников с синдромом Холта-Орама;
- вирусные болезни матери;
- эндокринные нарушения в организме женщины (особенно диабетический синдром);
- систематическое отравление плода запрещенными медикаментами, алкоголем;
- проживание и работа в экологически неблагоприятных местностях;
- повышенный радиационный фон в местах постоянного пребывания;
- осложнения беременности (угрозы прерывания, патологические токсикозы).
В перегородке между предсердиями может быть одно или несколько отверстий разного диаметра. От размеров просвета зависит скорость развития сердечно-легочных нарушений в работе органов, развитие дыхательной недостаточности и цианоза (посинения кожных покровов даже в состоянии покоя). Из-за неправильного распределения давления в предсердиях происходит выбухание правой стороны сердца, что приводит к сужению легочной артерии, повышению давления, дыхательной недостаточности.
Реабилитация после лечения дефекта межпредсердной перегородки у детей
После оперативного вмешательства пациент проведет несколько дней под присмотром медперсонала. В этот период медики тщательно следят за гемодинамическими показателями, водно-электролитным и кислотно-щелочным балансом, работой всех органов и систем. Объем терапии определяется индивидуально.
Лучшие реабилитологи «Хадассы» составят индивидуальный план восстановления. При необходимости больного переведут в специализированное отделение.
После возвращения домой реабилитацией будут заниматься родители — им дадут рекомендации и обучат правильному уходу за ребенком. |
После выписки ребенок наблюдается по месту жительства. В течение полугода нельзя посещать детский сад. Школьников переводят на индивидуальное обучение
Очень важно придерживаться принципов правильного питания, следить за интенсивностью физических нагрузок
Часто задаваемые вопросы
Среднее время пребывания в стационаре 3-4 дня. Как правило, в день поступления утром вы проходите обследование, включающее в себя клинический и биохимический анализ крови (приезжать нужно натощак), делаете рентгеновский снимок, ЭКГ, ультразвуковое исследование сердца и консультацию кардиолога и кардиохирурга. Если все показатели в норме, на следующий день проводится операция по устранению порока. На третий день мы проводим контрольные исследования и выписываем Вас.
Для госпитализации в наш стационар вам понадобится паспорт или свидетельство о рождении ребенка.
Если пациент детского возраста, нужна справка о санэпидокружении (о том, что в последнее время ребенок не контактировал с инфицированными больными), которую вы получите в поликлинике по месту жительства.
Желательно иметь при себе предыдущие консультативные заключения, ЭКГ и рентгеновский снимок органов грудной.
Направление от кардиолога по месту жительства НЕ ТРЕБУЕТСЯ. Вы можете приехать на консультацию и последующее лечение в порядке самообращения. Если Вам более 30 лет или вы ощущали перебои в работе сердца, желательно провести холтеровское мониторирование по месту жительства. Такое исследование можно провести и у нас, но это увеличит Ваше время пребывания в стационаре на 1-2 дня.
Если вы страдаете хроническим гастритом, язвенной болезнью желудка или двенадцатиперстной кишки необходимо сделать фиброгастродуоденоскопию. В случае подтверждения заболевания, Вам необходимо пройти курс лечения по месту жительства. Такое исследование можно провести и у нас, но это увеличит Ваше время пребывания в стационаре на 1-2 дня в случае отсутствия язв и эррозий.
Как правило, длительность операции в пределах 1-1,5часа. Но при сложных анатомических вариантах время операции может увеличится.
Всем взрослым пациентам операция проводится под местной анестезией. Пациент может наблюдать за ходом операции и общаться с персоналом. Исключение составляют пациенты с дефектом межпредсердной перегородки, которым во время операции требуется контроль транспищеводного УЗИ и для комфорта пациента операция проводится в состоянии медикаментозного сна. Все эндоваскулярные операции у детей и мнительных пациентов проводятся под общей анестезией.
Самый неприятный момент – это укол местного анестетика в паховую область. Затем болевая чувствительность полностью исчезает.
Через 3-6 месяцев имплантированные устройства полностью прорастают своими клетками – покрываются эндотелием и их уже не отличить от внутренней поверхности сердца. Все устройства выполнены из высокотехнологичного медицинского сплава, который не вызывает реакций отторжения или аллергических реакций.
Нет, установленные устройства не ощущаются.
Да, на КТ ограничений нет. На МРТ производители имплантов гарантируют безопасность при 1,5 и 3 Тесла. Перед обследованием обязательно сообщите радиологу о том, что у Вас установлен внутрисердечный имплант.
Необходимо ограничить сильную физическую нагрузку на 6 месяцев. Необходима профилактика респираторных инфекций, тонзиллита, кариеса. В случае, если заболевание начало развиватьс я, в схему лечения нужно включить антибактериальные препараты, после консультации с врачом. В течении первого месяца после операции необходимо также ограничить половую жизнь.
Немедленно вызовите скорую помощь, указав по телефону какой вид операции Вы перенесли. Затем перезвоните врачу, который делал операцию.
Часто задаваемые вопросы
Каким способом производится обезболивание при операции?
Анестезия может быть как местной, так и общей. Выбор зависит от решения врачей, которые будут проводить эту операцию. Если пациент хорошо переносит общий наркоз, то вполне возможен этот вариант, чтобы исключить волнение и неприятные ощущения.
Как осуществляется контроль за выполнением эндоваскулярного вмешательства?
Достаточно часто требуется уточнение строения дефекта, тогда на этом этапе выполняют ангиографию – рентгеноконтрастное исследование сосудов. Окклюдер подбирают индивидуально, его помещают в катетер и доводят до сердца. Затем, под контролем с помощью видеоизображений, производится установка и раскрытие окклюдера.
Если требуется дополнительный контроль над работой сердца, то используют эхокардиограф с датчиком, помещаемым в пищевод. Чреспищеводная Эхокардиография позволяет наблюдать за состоянием сердечной мышцы в режиме реального времени.
Как проводится реабилитация после манипуляции?
Общий срок проведения операции – не более 1,5-2 часов. Обычно процедура занимает около часа. Госпитализация производится на срок от суток до недели – зависит от индивидуального состояния пациента. После операции назначают прием антикоагулянтов – препаратов, препятствующих образованию тромба, а также антибиотиков, которые позволяют избежать бактериальной инфекции сердца.
Если в послеоперационном периоде не возникает осложнений, то требуется контрольное обследование через 3-4 недели. Иногда возникают такие симптомы, как боли и одышка. При появлении осложнений необходимо обратиться к лечащему врачу – при правильно проведенной операции побочные эффекты не развиваются.
9.2. ТЕТРАДА ФАЛЛО
Тетрада Фалло – врождённый порок сердца, характеризующийся наличием четырёх компонентов: 1) большого высокорасположенного ДМЖП; 2) стеноза лёгочной артерии; 3) декстропозиции аорты; 4) компенсаторной гипертрофии правого желудочка.
Распространённость
Тетрада Фалло составляет 12-14% всех врождённых пороков сердца.
ГЕМОДИНАМИКА
При тетраде Фалло аорта располагается над большим ДМЖП и над обоими желудочками, в связи с чем систолическое давление в правом и левом желудочках одинаковое (рис. 9-2). Главный гемодинамический фактор – отношение между сопротивлением кровотоку в аорте и в стенозированной лёгочной артерии.
Рис. 9-2. Анатомия и гемодинамика при тетраде Фалло. А – аорта; ЛА – лёгочная артерия; ЛП – левое предсердие; ЛЖ – левый желудочек; ПП – правое предсердие; ПЖ – правый желудочек; НПВ – нижняя полая вена; ВПВ – верхняя полая вена. Короткая стрелка указывает на дефект межжелудочковой перегородки, длинная – на подклапанный стеноз лёгочной артерии.
• При небольшом сопротивлении в лёгочных сосудах лёгочный кровоток может быть вдвое больше кровотока в большом круге кровообращения, и насыщение артериальной крови кислородом может быть нормальным (ацианотичная тетрада Фалло).
• При значительном сопротивлении лёгочному кровотоку возникает сброс крови справа налево, в результате чего возникают цианоз и полицитемия.
Стеноз лёгочной артерии может быть инфундибулярным или комбинированным, реже клапанным (подробнее об этом см. в главе 8 “Приобретённые пороки сердца”).
При физической нагрузке происходит увеличение притока крови к сердцу, но кровоток через малый круг кровообращения не возрастает из-за стенозированной лёгочной артерии, и избыточное количество крови сбрасывается в аорту через ДМЖП, поэтому цианоз усиливается. Возникает гипертрофия, что приводит к усилению цианоза. Гипертрофия правого желудочка развивается вследствие постоянного преодоления препятствия в виде стеноза лёгочной артерии. В результате гипоксии развивается компенсаторная полицитемия – увеличивается количество эритроцитов и гемоглобина. Развиваются анастомозы между бронхиальными артериями и ветвями лёгочной артерии. У 25% больных обнаруживают правостороннее расположение дуги аорты и нисходящей аорты.
КЛИНИЧЕСКАЯ КАРТИНА И ДИАГНОСТИКА
Жалобы
Основной жалобой взрослых больных тетрадой Фалло является одышка. Кроме того, могут беспокоить боли в сердце без связи с физической нагрузкой, сердцебиение. Больные склонны к лёгочным инфекциям (бронхиты и пневмонии).
Осмотр
Отмечают цианоз, степень выраженности которого может быть различной. Иногда цианоз настолько выражен, что синеют не только кожные покровы и губы, но также слизистая оболочка полости рта, конъюнктива. Характерно отставание в физическом развитии, изменение пальцев (“барабанные палочки”), ногтей (“часовые стёкла”).
Пальпация
Обнаруживают систолическое дрожание во II межреберье слева от грудины над участком стеноза лёгочной артерии.
Аускультация сердца
Выслушивают грубый систолический шум стеноза лёгочной артерии во II-III межреберьях слева от грудины. II тон над лёгочной артерией ослаблен.
Лабораторные исследования
Общий анализ крови: высокий эритроцитоз, повышение содержания гемоглобина, СОЭ резко снижена (до 0-2 мм/ч).
Электрокардиография
Электрическая ось сердца обычно смещена вправо (угол α от +90° до +210°), отмечают признаки гипертрофии правого желудочка.
Эхокардиография
ЭхоКГ позволяет обнаружить анатомические составляющие тетрады Фалло.
Рентгенологическое исследование
Отмечают повышенную прозрачность лёгочных полей из-за уменьшения кровенаполнения лёгких. Контуры сердца имеют специфическую форму “деревянного башмака сабо”: уменьшенная дуга лёгочной артерии, подчёркнутая “талия сердца”, закруглённая и приподнятая над диафрагмой верхушка сердца. Дуга аорты может быть справа.
ОСЛОЖНЕНИЯ
Наиболее часто возникают инсульты, ТЭЛА, выраженная сердечная недостаточность, инфекционный эндокардит, абсцессы мозга, разнообразные аритмии.
ЛЕЧЕНИЕ
Единственный метод лечения – хирургический (радикальная операция – пластика дефекта, устранение стеноза лёгочной артерии и смещение аорты). Иногда хирургическое лечение состоит из двух этапов (первым этапом ликвидируют стеноз лёгочной артерии, а вторым проводят пластику ДМЖП).
Преимущества эндоваскулярной методики
Эндоваскулярный способ закрытия дефекта выгодно отличается от операции по ушиванию ДМПП. Последняя требует искусственного поддержания кровообращения во время операции, имеет больше противопоказаний и значительный период реабилитации. Несмотря на то, что хирургическое лечение прочно вошло в практику и применялось долгое время, сейчас оно уступает место эндоваскулярному методу.
Главное преимущество в том, что эндоваскулярная операция – это малоинвазивная хирургия. После нее не остается шрамов, процедура не требует разрезов или открытого доступа. У эндоваскулярного метода чрезвычайно низкий процент послеоперационных осложнений. Пациентам не требуется длительная госпитализация и реабилитация.
На данный момент эндоваскулярная операция – это общепризнанный мировой стандарт, отвечающий всем требованиями безопасности и эффективности.
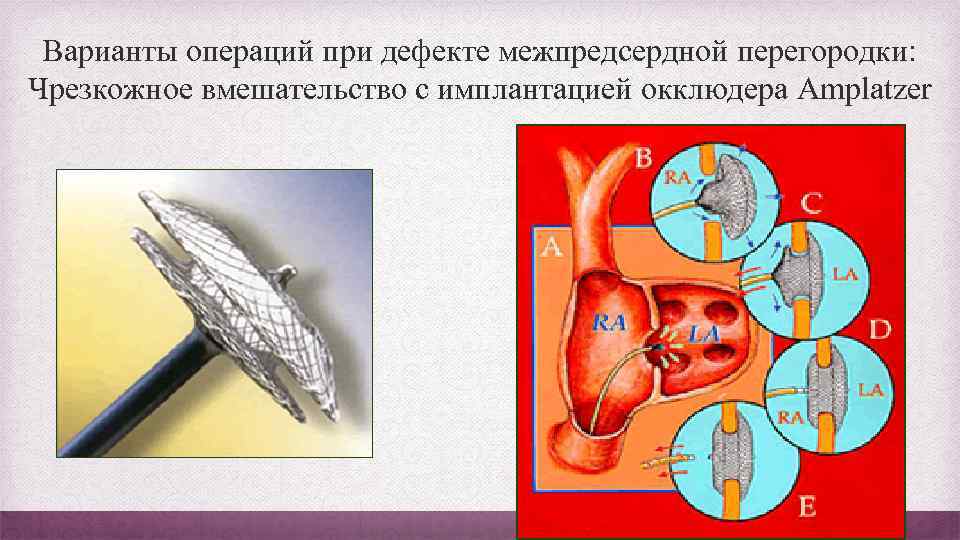
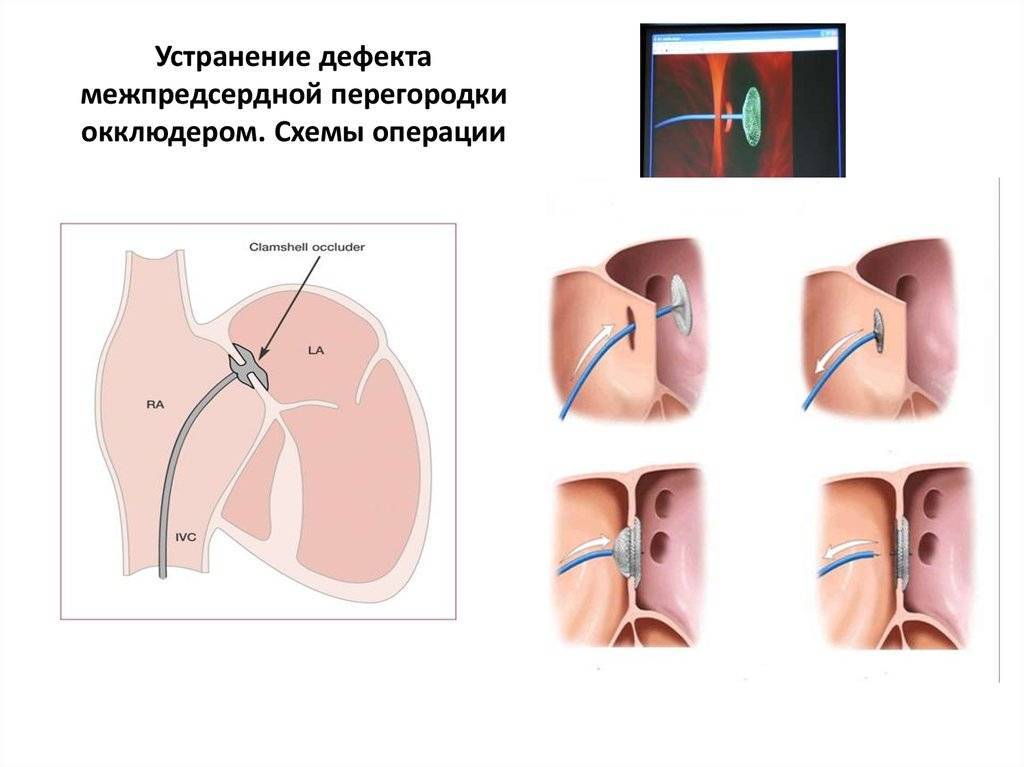
Принцип работы окклюдера
Впервые операция с помощью окклюдера была произведена в конце 80-х годов прошлого века – это был эксперимент на животных. Окклюдер – это специальное устройство, которое устанавливают через сосудистый доступ, а после установки оно выполняет функцию заплатки. Со временем техника выполнения таких операций совершенствовалась, и сейчас успешно применяется для лечения тысяч пациентов. Уже в 21 веке появилось множество модификаций и разновидностей окклюдеров для разных случаев.
Принцип работы устройства следующий: конструкция, раскрывающаяся подобно зонтику, заводится в нужное место через сосуд. После установки заплатки никаких других манипуляций не требуется. Окклюдер производят из сплавов металлов, давно применяемых в медицине – из никеля и титана, покрытых сверху специальным биосовместимым волокном. Материалы протестированы множество раз, они не вызывают аллергии. Устройство сконструировано таким образом, что центровка в отверстии перегородки происходит самостоятельно – задача врача довести окклюдер по сосудам до нужного места. Модель устройства подбирается в зависимости от конкретного дефекта – существуют разные модификации для лечения разных пороков сердца.
Доставка к сердцу производится с помощью катетера, который заводят в крупный сосуд – артерию или вену бедра. Размер окклюдера не больше 2,5 мм в диаметре, поэтому он спокойно проходит по сосудистому руслу. Устройство раскрывается только после установки в соответствующее положение рядом с дефектом перегородки.
Операция выполняется квалифицированными врачами, прошедшими специальное обучение. Процедура проводится в операционной. Пациент во время операции лежит. Врач может контролировать все свои действия с помощью специального оборудования, передающего изображение на мониторы. В ходе операции проводится мониторинг жизненных показателей.
Читать полностью
Врачи, выполняющие эндоваскулярное закрытие дефекта межпредсердной перегородки
Бабунашвили Автандил Михайлович
Врач сердечно-сосудистый хирург, заведующий отделением сердечно-сосудистой хирургии, доктор медицинских наук, профессор, заслуженный врач РФ
Стаж 34 года
Записаться на прием
Причины возникновения ДМЖП у плода
Любые пороки сердца, и ДМЖП в том числе, чаще всего возникают в первом—втором триместре беременности под влиянием неблагоприятных факторов. Именно в этот период начинают закладываться ткани сердечной мышцы и кровеносной системы. Любое нарушение нормального процесса формирования и деления клеток может приводить к тяжелым последствиям.
Возникает ДМЖП у плода по причине таких обстоятельств как:
- острое инфекционное заболевание беременной в первом триместре,
- хронические инфекционные болезни матери,
- влияние на организм беременной токсинов, алкоголя, никотина,
- пожилой возраст одного из родителей,
- наследственная отягощенность и пр.
Очень часто при ДМЖП причины возникновения патологии вообще не обнаруживаются. Поэтому в зоне риска может быть абсолютно любой ребенок.
Для выявления ДМЖП и причин его возникновения предусмотрен ряд диагностических мероприятий. Чаще всего необходимую информацию о здоровье сердца плода удается получить по данным ультразвукового исследования.