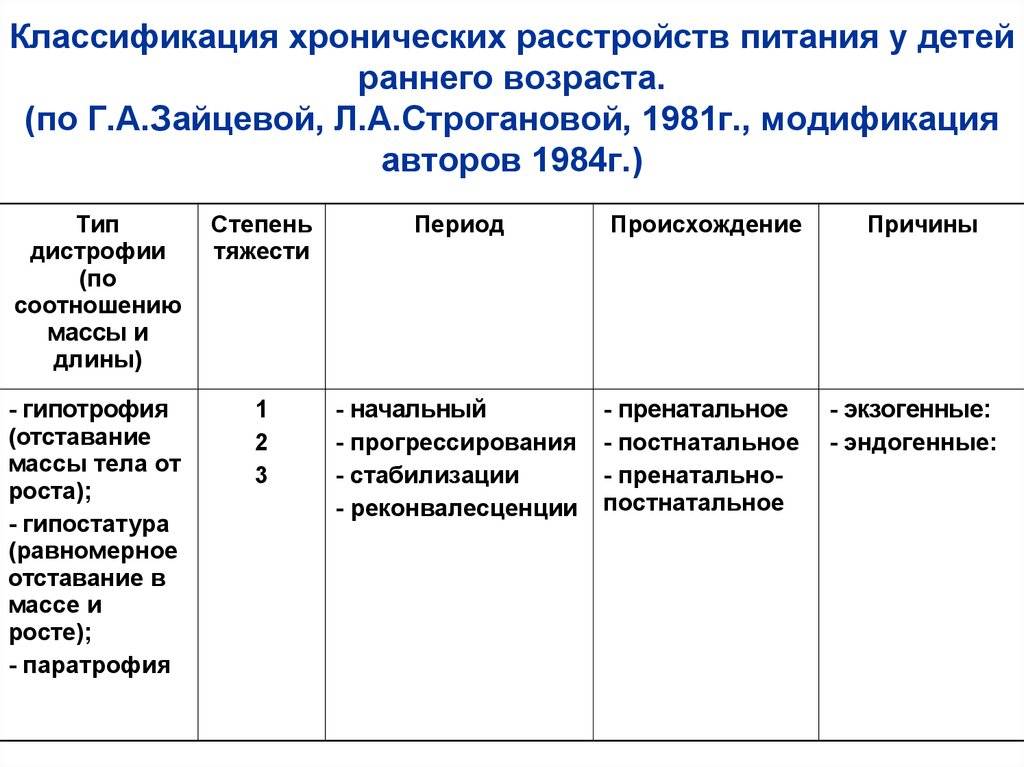
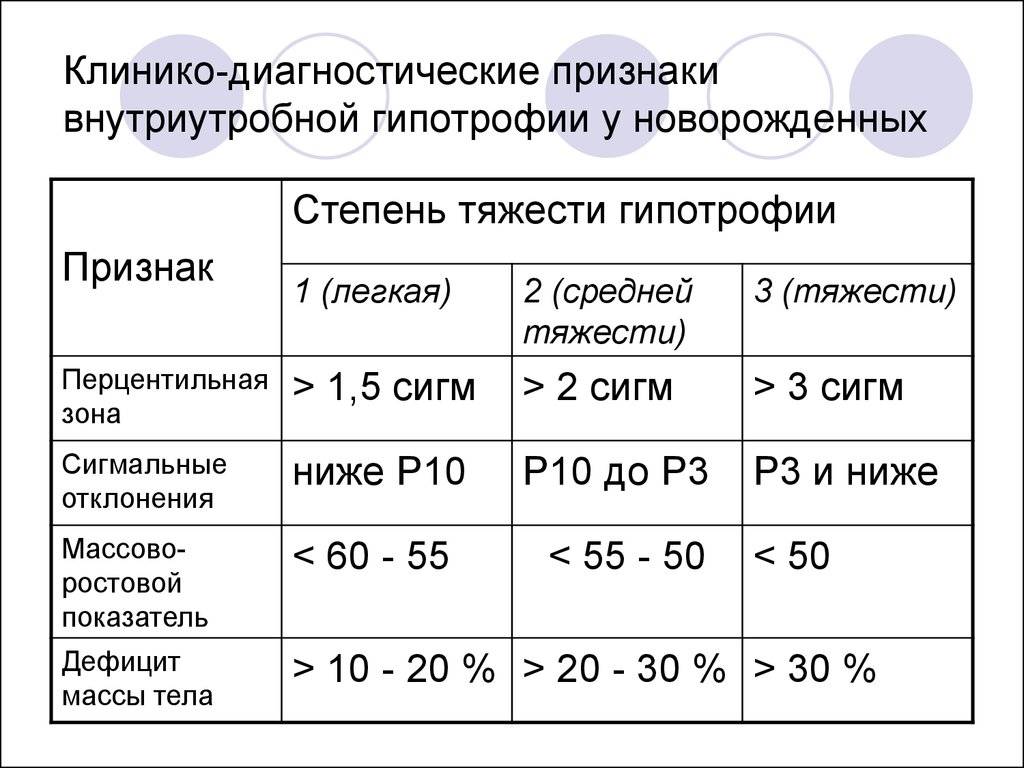
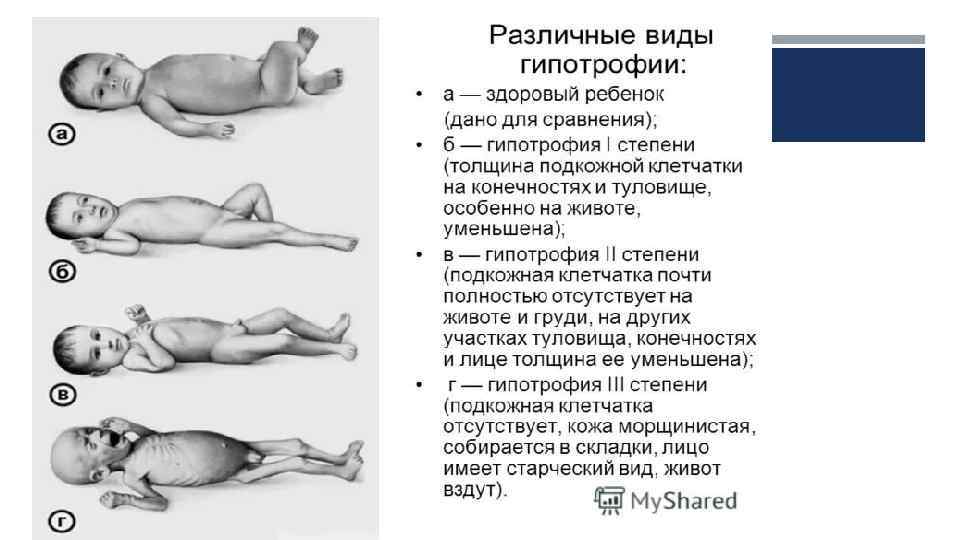
Симптомы Гипотрофии у ребенка:
Приобретенная гипотрофия у ребенка характеризуется такими симптомами:
- ненормально маленький вес тела
- дефицит подкожной клетчатки
- потеря активности в отличие от недавнего времени
- пониженный тургор подкожной жировой прослойки
- сухость кожи и явный недостаток влаги на слизистых оболочках
- изменения лица и тела ребенка
- визуально голова кажется больше остального тела
- стягивание кожи и образование на ней морщин
- уменьшение мышечной массы
- на теле «прорисовываются» косточки
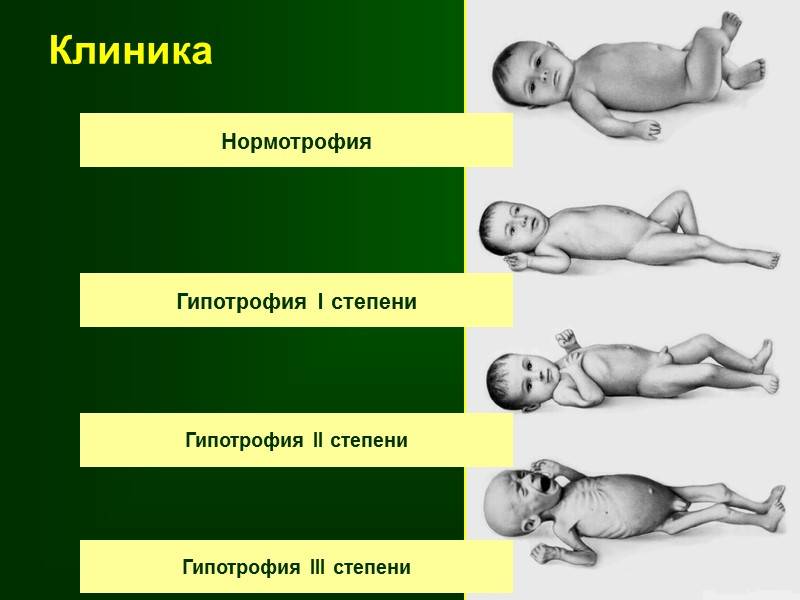
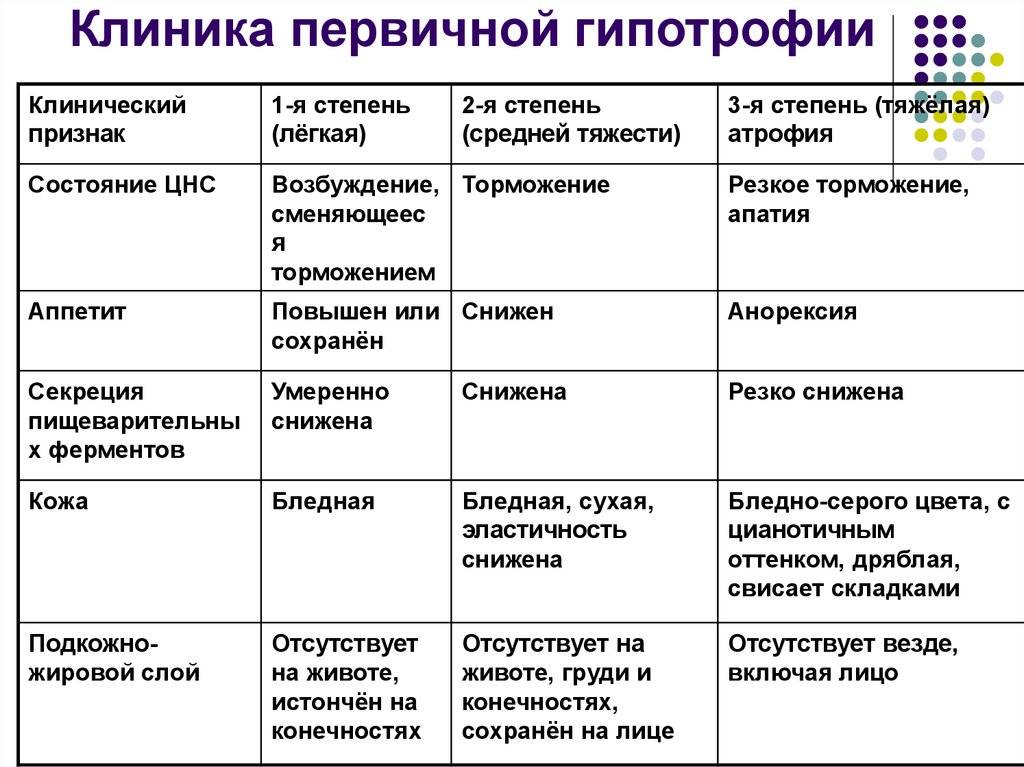
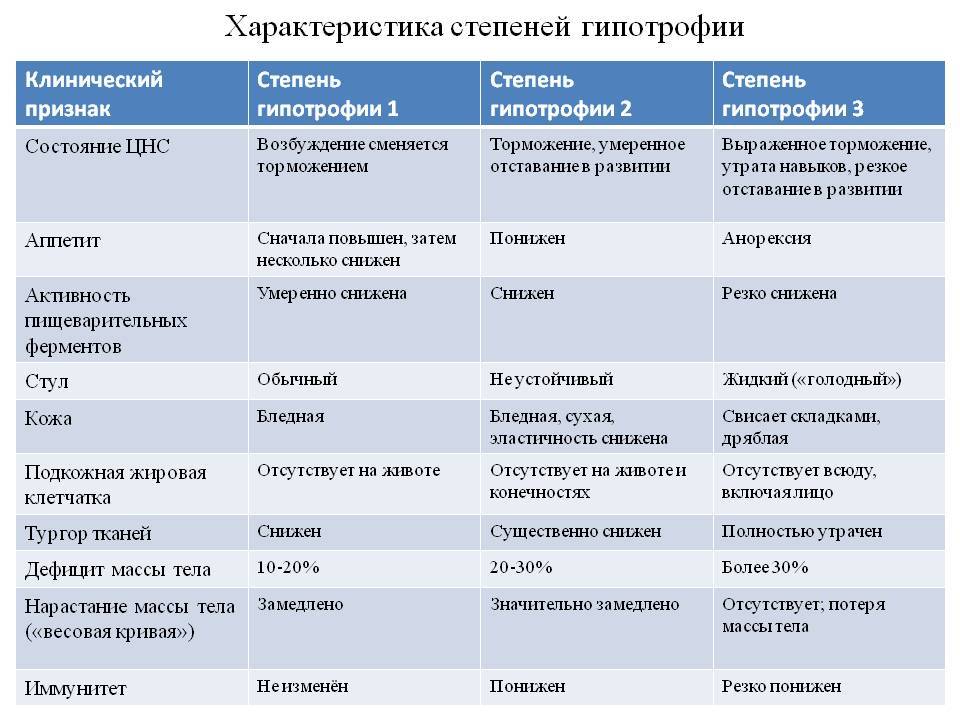
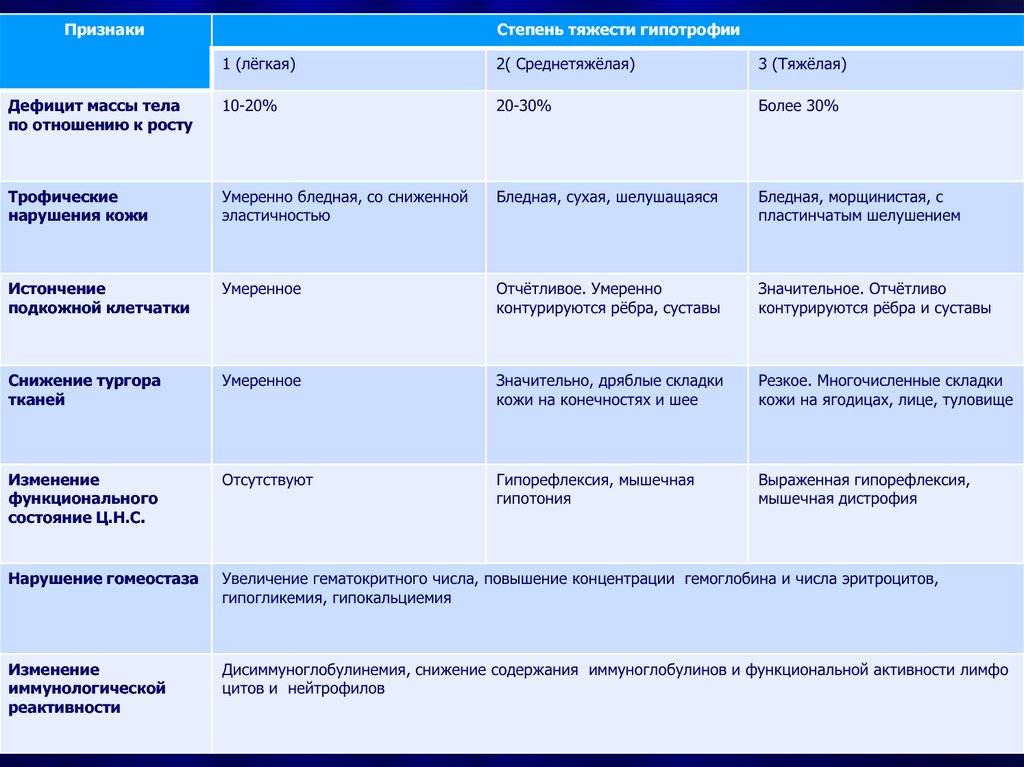
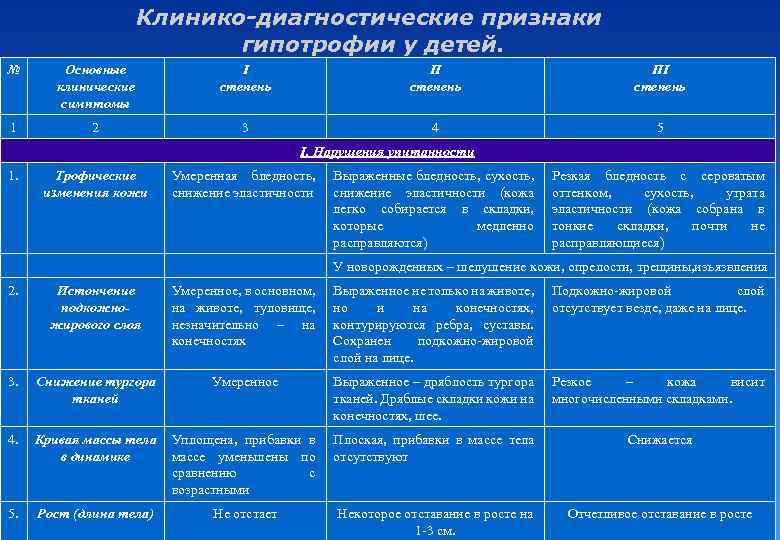
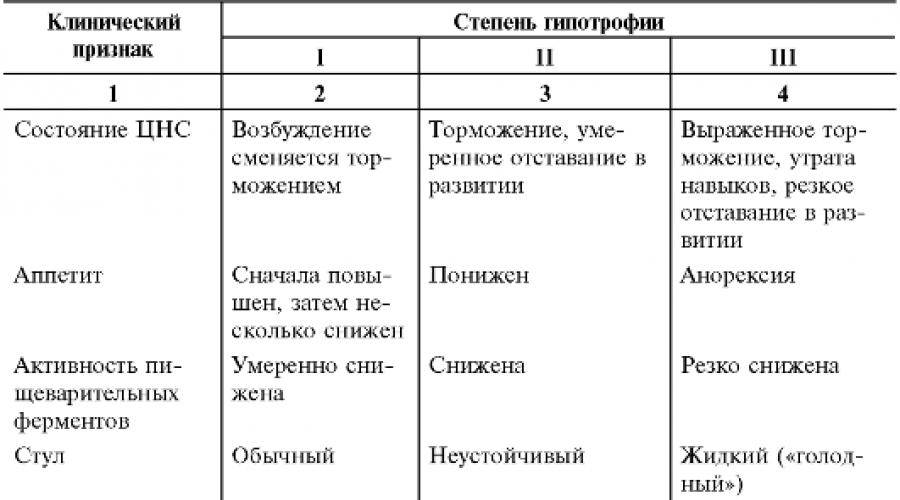
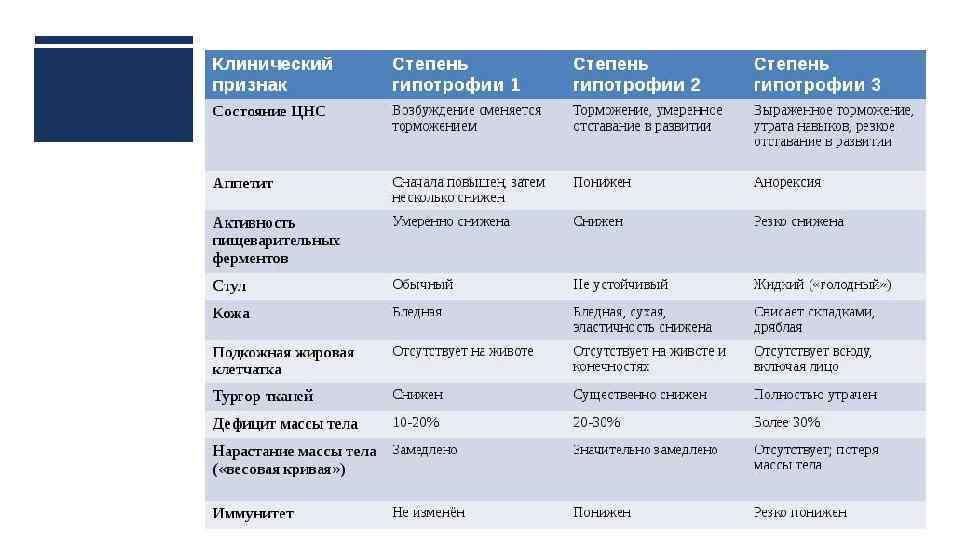
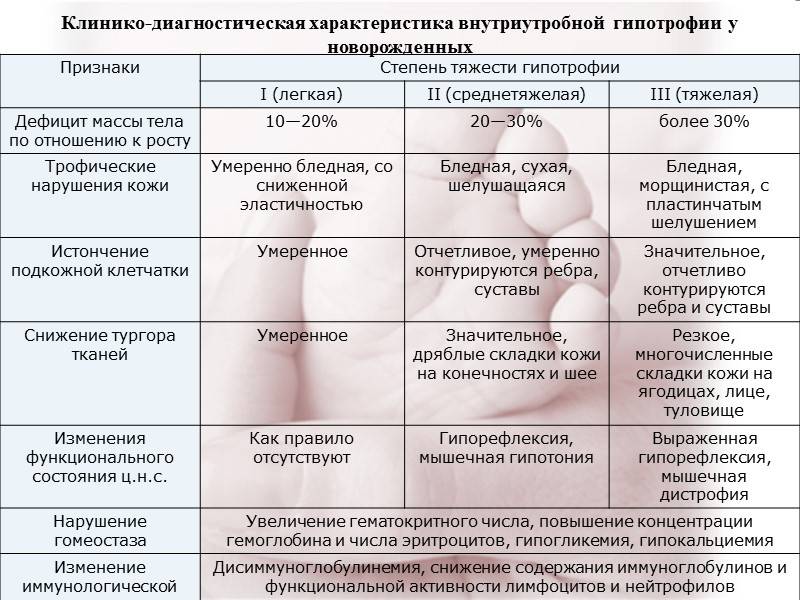
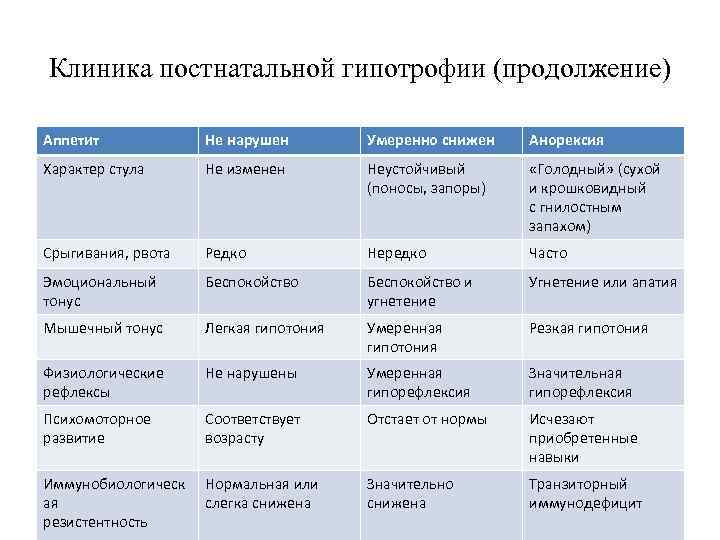
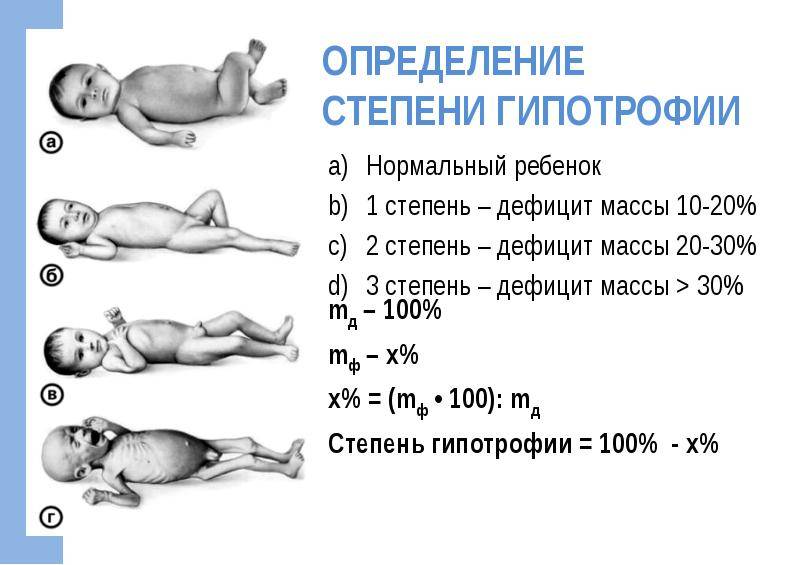
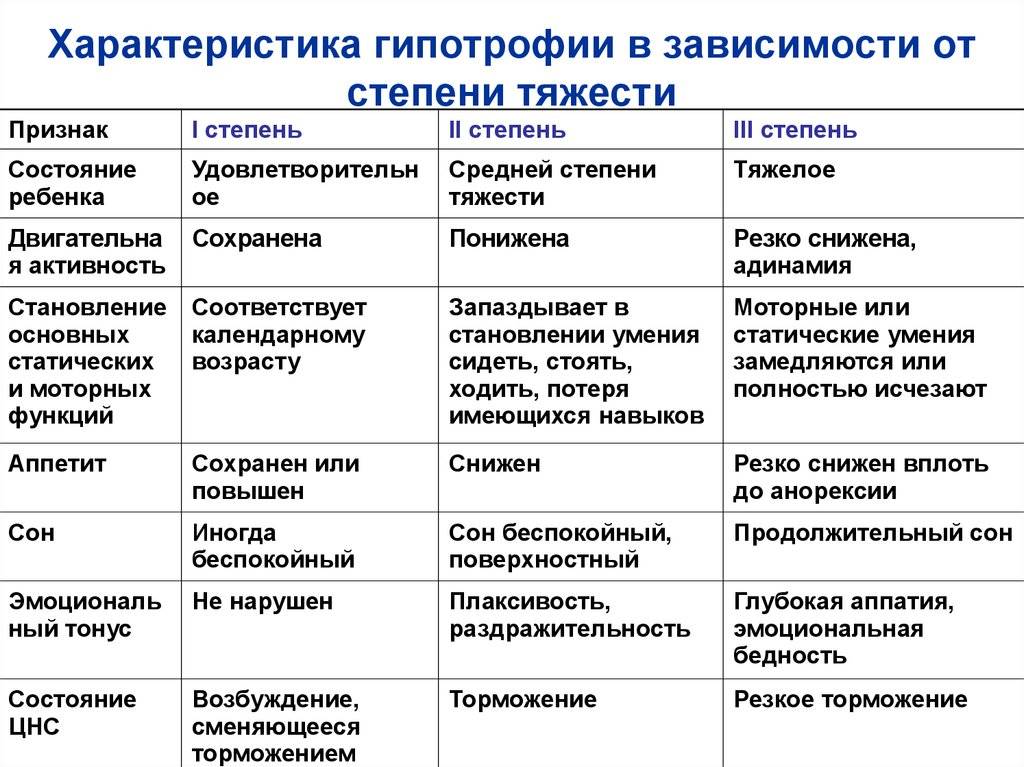
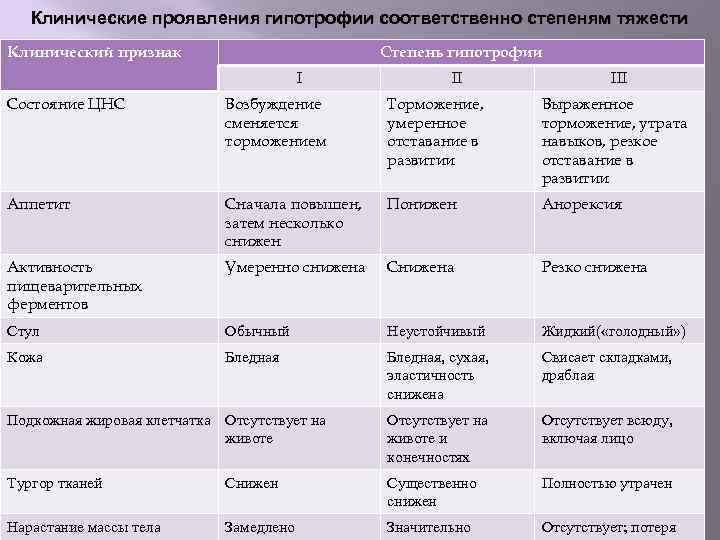
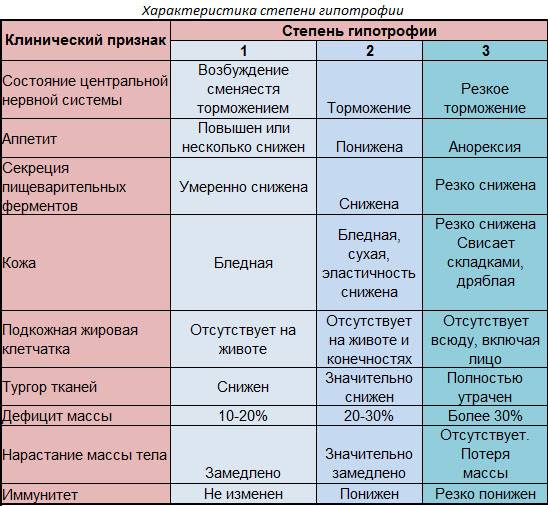
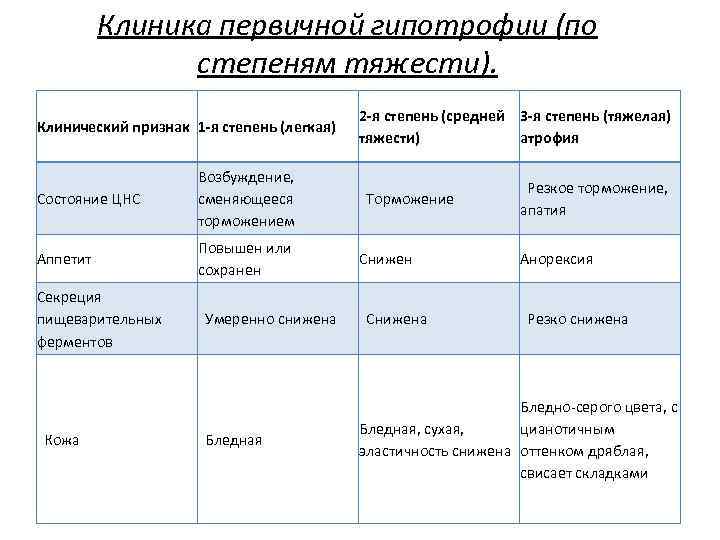
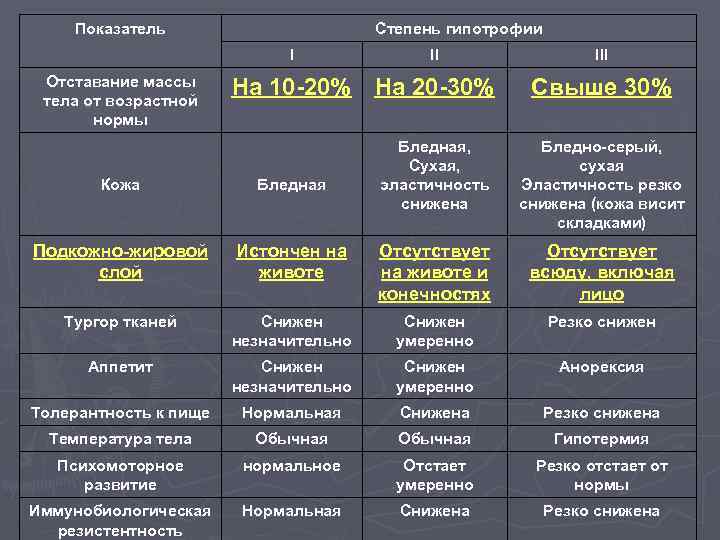
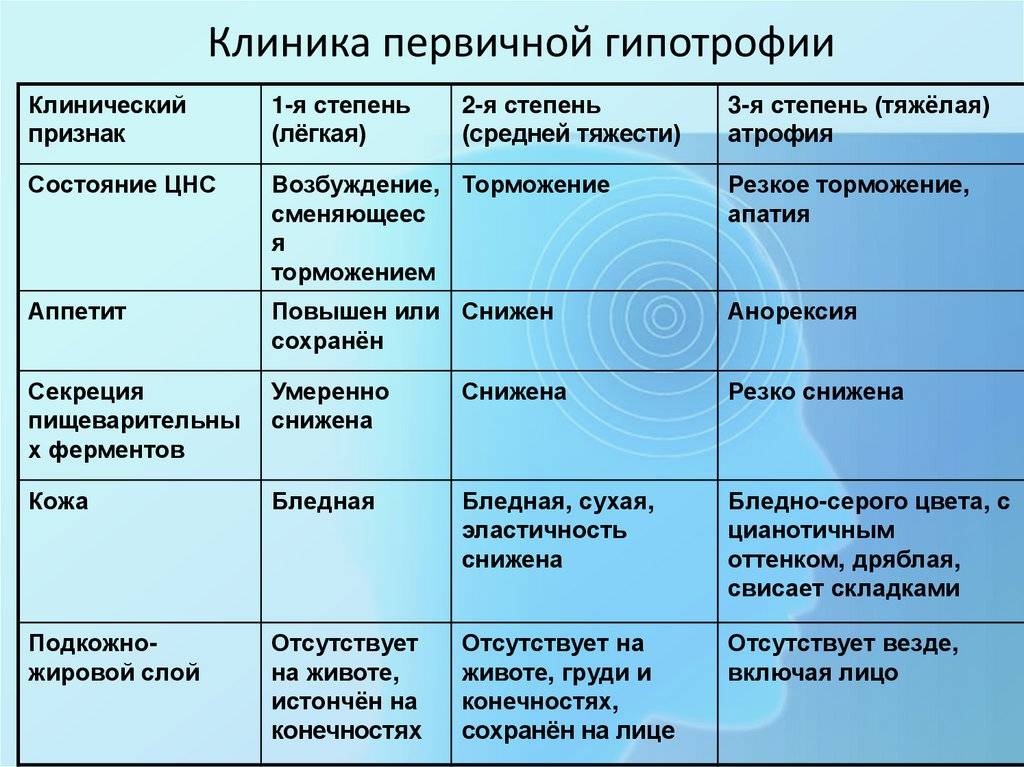
Недостаточность веса бывает трех степеней: первой, второй, третьей. Изменения при первой степени видны в первую очередь на животе. Заметно снижается мышечный тонус. Отмечается бледность кожи. Под глазками появляются большие синяки, кроме того, кожа очень сохнет и теряет эластичность. При первой степени гипотрофии вес ребенка отстает от нормы на 15-20%, рост в норме, развитие в норме. Ребенок может капризничать, быть излишне раздражительным, плохо спит. Может быть частое срыгивание и анемия.
При второй степени полностью отсутствует жир под кожей на животике, руках и ногах, но на щечках он еще есть. Кожа становится сероватой, дряблой, со складками. В уголках рта появляются трещины, развивается хрупкость ногтей и ломкость волос, а также их выпадение. Груднички становятся не просто раздражительными, а постоянно плачущими. Наблюдается отставание в развитии. Наблюдаются такие симптомы как анемия, понс (не во всех случаях). Снижение веса – до 30%.
Третья степень гипотрофии у ребенка самая тяжелая. По всему телу нет жировой прослойки. Кожа бледная и сухая, на сгибах могут быть трещины. Вес потерян более чем на 30%. Может наблюдаться вздутие живота.
Причины возникновения гипотрофии
Перечень причин, способствующих возникновению данной патологии, достаточно обширный. Условно их делят на эндогенные (внутренние) и экзогенные (внешние). Кроме этого, отдельно рассматривают причины развития врожденной и приобретенной гипотрофии.
Основные факторы, которые влияют на развитие внутриутробной (пренатальной) гипотрофии:
- патология течения беременности;
- различные хромосомные мутации, генетические заболевания у плода;
- вредные привычки матери (курение, алкоголизм, употребление наркотических средств);
- хронические заболевания матери (сахарный диабет, врожденные или приобретенные пороки сердца, пиелонефрит и др.);
- неполноценное питание матери во время беременности;
- ранняя (до 19 лет) или наоборот, поздняя (после 36 лет) беременность;
- внутриутробное инфицирование плода, наличие у матери TORCH-инфекции;
- нервно-психическое перенапряжение, стрессы во время беременности.
В основе развития внутриутробной гипотрофии лежит нарушение маточно-плацентарного кровотока, что ведет к развитию внутриутробной гипоксии плода, нарушению трофических процессов, исходом которых является ЗВУР.
Приобретенная гипотрофия может возникать вследствие таких причин:
- Алиментарные факторы:
- количественно или качественно недостаточное питание;
- неправильное введение прикорма;
- искусственное вскармливание;
- неправильный режим кормления ребенка.
- Инфекционные факторы, когда гипотрофия связана с острыми или хроническими инфекционными заболеваниями.
- Токсические факторы (например, данная патология может возникнуть вследствие длительного применения некоторых медикаментов).
- Наличие у ребенка наследственных или приобретенных нарушений всасывания (лактазная недостаточность, целиакия и др.).
- Наследственные нарушения обмена веществ (галактоземия, фруктоземия и др.).
- Различные врожденные аномалии развития внутренних органов.
- Врожденные или приобретенные иммунодефицитные состояния.
- Эндокринная патология у ребенка (сахарный диабет, гипертиреоз и др.).
- Тяжелые травмы.
- Заболевания центральной нервной системы (ЦНС).
- Онкологическая патология.
Нарушение поступления в организм ребенка питательных веществ, а также их расщепления и переваривания влечет за собой снижение ферментативной активности, нарушение моторики органов желудочно-кишечного тракта (ЖКТ), что в свою очередь приводит к разладу всех видов обмена веществ. В дальнейшем у ребенка отмечаются изменения иммунологической реактивности (снижается иммунитет), нарушается работа ЦНС и других систем организма, возникают дефицитные заболевания.
Патогенез
Несомненно, что целиакия без глютена не возникает, но однозначных мнений о ее патогенезе до настоящего времени нет, поэтому существует ряд гипотез.
1) Сенсибилизация глиадином, вследствие чего эпителий кишечника становится мишенью для развития иммунологического процесса. Попадая в слизистую оболочку, белковый антиген (глютен) подвергается расщеплению в лизосомах макрофага до пептидов. Пептиды связываются с молекулами HLA II класса, находящимися в эндоплазматической сети той же клетки. При этом пептиды подвергаются дезаминированию в присутствии фермента тканевой трансглютаминазы – TG2, что обеспечивает более тесное связывание пептидных остатков глютена с молекулами DQ2 и DQ8. Этот комплекс презентируется на мембране макрофага и распознается лимфоцитами, прошедшими через пейеровы бляшки. Активированные Т-лимфоциты превращаются в цитотоксические клетки, несущие CD8маркеры (киллеры), и хелперы (Th1 и Th2), являющиеся CD4-положительными. При этом содержание CD4-лимфоцитов в собственной пластинке слизистой оболочки возрастает почти в 50 раз, а CD8 Т-клеток в эпителии – почти в 10 раз. Th1 продуцируют ИЛ-2, фактор некроза опухоли (TNF) и интерферон-γ, индуцирующие воспаление и активирующие цитотоксический иммунный ответ; Th2 – значительное количество ИЛ-4, 5 и 10, тормозящего активность Th1. В свою очередь TNF активирует металлопротеазы, в частности ММР-3 и ММР-1, нарушая структуру субэпителиальной области слизистой оболочки и разрушая коллаген. В-лимфоциты потенцируют выработку антител к глютену и тканевой трансглютаминазе. Параллельно происходит выработка аутоантител к TG2, которые в виде депозитов IgA располагаются в субэпителиальном слое кишки, на фибробластах, а также в печени, лимфатических узлах, мышцах, кровеносных сосудах. Блокирование тканевой трансглютаминазы аутоантителами ведет к деструкции эпителия и слизистой, атрофии ворсин и пролиферации клеток эпителия крипт, что усиливает проницаемость слизистой, в том числе и для глютена.
2) Роль вирусов в патогенезе целиакии (у некоторых больных в крови определяется повышение титров антител к аденовирусам типа 12, снижение которых отмечено при улучшении состояния больных на фоне аглиадиновой диеты).
При целиакии имеет место аутосомно–доминантный тип наследования с неполной пенетрантностью. У ближайших родственников больного частота заболевания варьирует от 2 до 12% по данным гистологического исследования слизистой оболочки тонкой кишки. У однояйцовых близнецов конкордантность по целиакии составляет примерно 70%, у HLA–идентичных лиц – до 30%. Родители пациентов с целиакией сами страдают глютеновой энтеропатией в скрытой форме примерно в 14% случаев.
Лечение Гипотрофии у ребенка:
В комнате, где большую часть дня находится ребенок с гипотрофией, нужно поддерживать температуру 24-27°С. Следует контролировать одежду ребенка при прогулках, а также время нахождения вне квартиры. Если на улице температура ниже 5°С, ребенка с гипотрофией не следует выносить из помещения.
Следует уделять большое внимание гигиене гипотрофиков, потому что у них очень снижен иммунитет. После стула ребенка моют и обрабатывают кожу детским увлажняющим кремом
Тщательно выбирают одежду, обращая внимания на ее состав. К телу не должны прилегать грубые швы. Предпочтение отдают натуральным тканям. В иных случаях у ребенка может быть аллергия и раздражения на коже.
Создавайте ребенку каждый день позитивные эмоции. Чаще играйте с ними. Ребенок должен правильно, сбалансировано и регулярно питаться. Используйте для питания новорожденных материнское молоко или специальные смеси, которые адаптированы для больных деток и малышей с недовесом. Добавьте в рацион витамины и полезные вещества, которые необходимы организму грудничка.
Питание делят на 2 фазы. Организм нужно приучить, что количество углеводов, жиров и белков будет расти. После привыкания организма малыша можно переводить на стандартное детское питание в дозах, соответствующих возрасту здорового ребенка. Не смотря на принятые меры гипотрофия может развиваться, если в ее основе лежит врожденный тяжелый порок или аномальное нарушение обмена веществ.
Прогноз гипотрофии
Прогноз хороший при обычной гипотрофии и адекватном лечении. При тяжелых формах гипотрофии прогноз зависит от того, насколько малыш защищен от вторичных инфекций, в особенности от плазмоцеллюлярной пневмонии, коли-энтерита, повторных банальных инфекций.
Ухудшает прогноз симптоматическая гипогликемия, которая говорит о том, что гипотрофия находится в третьей степени. Шансы выжить у ребенка зависят в этом случае от его возраста. Прогноз хуже при сопутствующих пороках развития. Улучшает прогноз благоприятная среда, в которой ребенок находится после проведения лечения в условиях стационара. После затяжной гипотрофии у грудничков может нарушиться умственное развитие.
Методы лечения гипотрофии
При наличии основной патологии, которая вызвала развитие гипотрофии, прежде всего проводятся лечебные мероприятия, направленные на терапию основного заболевания.
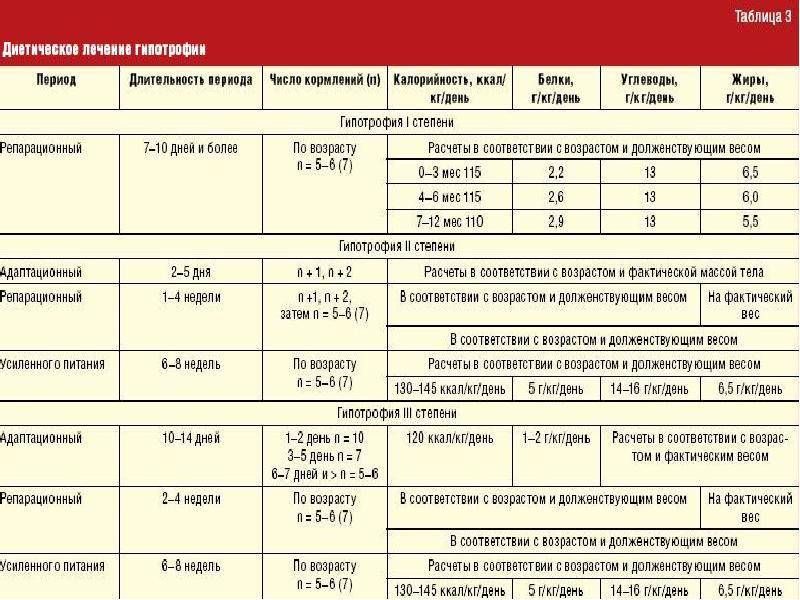
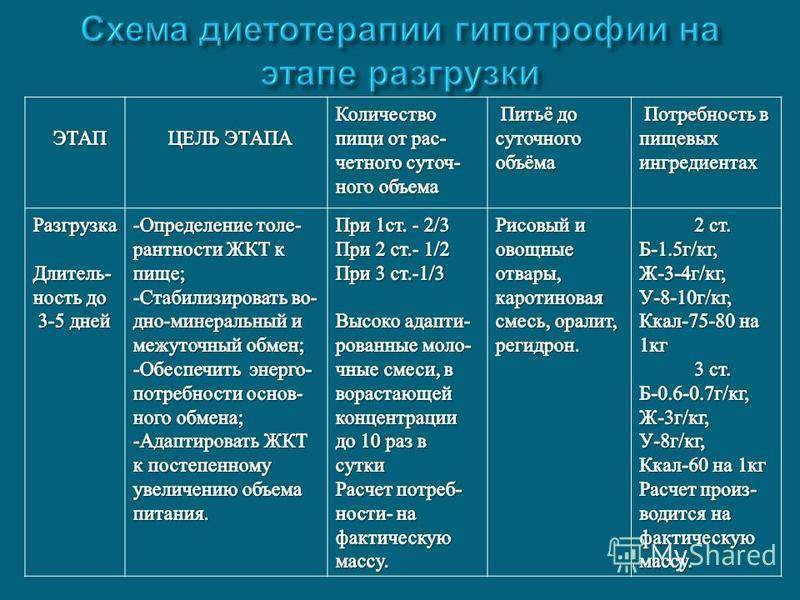
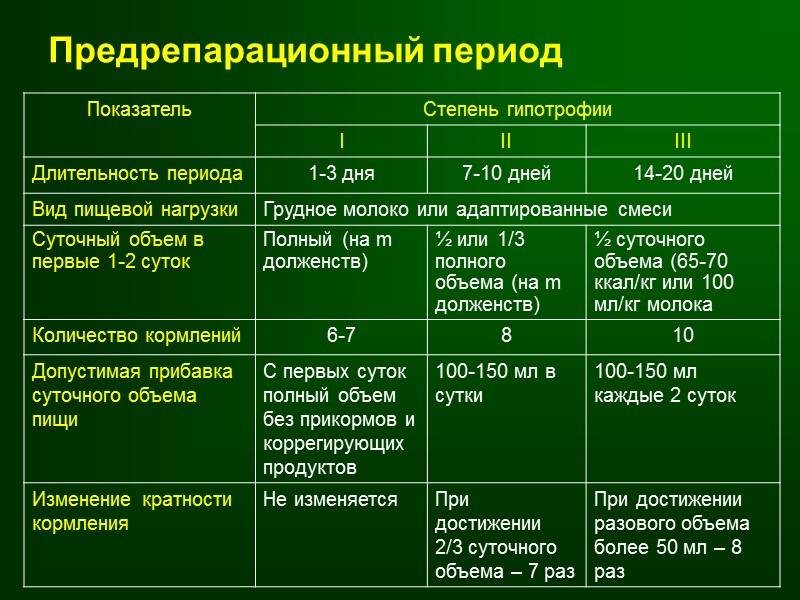
Лечение гипотрофии комплексное, ступенчатое, оно основано на постепенном выведении ребенка из данного патологического состояния. Обязательной является организация должного режима дня и питания ребенка. Основой лечения является диета. На первом этапе вырабатывают установление толерантности к пище, затем постепенно переходят к усиленному кормлению (период возрастания пищевых нагрузок), после чего производят полное выведение ребенка из гипотрофии. Дети с первой степенью патологии могут проходить лечение амбулаторно, под динамическим наблюдением врача, при среднетяжелой и тяжелой форме патологии ребенок должен быть госпитализирован в стационар. Обязательным является ежедневный контроль за массой тела пациента, а также ведение пищевого дневника, листа гидробаланса.
Медикаментозное лечение состоит в назначении ферментных препаратов для улучшения пищеварения, витаминов, пробиотиков, при необходимости проводят инфузионную терапию.
Лечение данного заболевания является достаточно сложным процессом, где для достижения желаемого эффекта нужно учесть очень много нюансов, поэтому самолечение такого ребенка в домашних условиях является недопустимым и может быть крайне опасным для его жизни и здоровья.
Симптомы
Гипотрофия — это расстройство питания, симптомы которого могут иметь не только конституциональные признаки, но и затрагивать определенные системы органов. Ранние симптомы питания с низким содержанием белка включают усталость, раздражительность, апатию.
По мере развития дефицита появляются более серьезные признаки:
- изменение кожной пигментации;
- снижение мышечной массы;
- неспособность набирать вес и рост согласно возрасту;
- изменения цвета или текстуры волос;
- нарушения в работе иммунной системы, приводящие к увеличению частоты и тяжести инфекций;
- потеря мышечной массы;
- выступающий сильно живот;
- диарея, усугубляющаяся дефицитом кишечных дисахаридаз, особенно лактазы;
- временный дефицит лактозы и ахлоргидрия;
- кожные высыпания;
- отёчность;
- атрофия ткани гонады;
- потеря либидо у мужчин и женщин;
- аменорея у женщин.
Гипотрофия мышц позволяет спортсменам создать красивую форму тела
Низкий уровень белка приводит к задержке умственного и физического развития. Постоянный дефицит белка может привести к состоянию шока, коме.
Истощение жира и мышц распространено во всех формах гипотрофии. При исследовании было замечено, что белковое голодание от 30 до 40 дней приводит к потере 25% от исходного веса. При длительном голодании потеря веса увеличивалась до 50%.
У взрослых кахексия наиболее очевидна в тех местах, где имеются крупные жировые отложения. Мышцы сокращаются, кости выпячиваются. Кожа становится тонкой, сухой, неэластичной, бледной и холодной. Волосы сухие и легко выпадают, становятся редкими, заживление ран ухудшается. У пожилых пациентов повышается риск переломов бедра и возникновение пролежней.
При острой или хронической тяжелой форме гипотрофии размер сердца и сердечный выброс уменьшаются, пульс замедляется, артериальное давление падает. Частота дыхания, жизненная емкость, температура тела снижаются. Может развиться отек, анемия, желтуха и петехии, возникнуть печеночная, почечная или сердечная недостаточность. Тяжелая форма нередко приводит к летальному исходу.
Методы лечения
Гипотрофия — это расстройство питания, лечение которого можно разделить на 3 основных этапа:
- Восстановление статуса питания. На этом этапе лечение включает предоставление продуктов питания, которые легко перевариваются. Они должны быть хорошо распределены в течение дня, чтобы быстро и эффективно восстановить состояние питания.
- Реабилитация питания. Восстановление нормального кормления ребенка, исключение лактозы, обучение матери правильному статусу питания ребёнка, вскармливание ребёнка адаптированными молочными смесями.
- Госпитализация. При сопутствующих состояниях, таких как гипогликемия, обезвоживание, инфекция, гипотермия, анемия, дефицит витаминов или минералов, электролитный дисбаланс, необходимо поместить пациента в больницу под наблюдение врача.
Лекарственные препараты
Тяжелые случаи гипотрофии требуют лечения в стационаре с контролируемым питанием. Основная задача – восстановление жидкостно-электролитного баланса, лечение инфекций.
Для этого используются методики:
- лечение антибиотиками при наличии очагов инфекции;
- растворы с комплексами аминокислот или белковые компоненты крови, предназначенные для внутривенного введения;
- вливание макронутриентов перорально (витаминов, минеральных веществ, микроэлементов);
- парентеральное питание при нарушении всасывания (выбор стандартных смесей для энтерального питания зависит от характера и тяжести заболевания) назначается пациентам с тяжелыми формами белкового дефицита при заболеваниях желудочно-кишечного тракта или в послеоперационном периоде.
Дети, испытывающие диарею, получают внутривенную регидратацию. Кормление больных проводится по специальной схеме, часто, но понемногу. Проводится поэтапное кормление молочными смесями с добавками.
Ежедневно, 2 раза в сутки, следует давать питательные микроэлементы:
- Витамины группы В. Первые сутки дают увеличенную в 2 раза витаминную дозу.
- Магний, 0,4 мг/кг веса, назначается в течение 1 недели.
- Введение железа перорально или внутримышечно.
При лечении пожилых пациентов следует обратить внимание на причину, вызвавшую избыточную выработку цитокинов. Как правило, к этому приводят такие заболевания, как рак, СПИД
Назначаются препараты для кратковременного курса, не более 3 недель:
- Ацетат мегестрола, назначается при паллиативном лечении рака молочной железы, при лечении анорексии, уменьшении массы тела.
- Медроксипрогестерон, применяется при раковой кахексии.
Пожилым с гипотрофией, вызванной почечной недостаточностью, назначается нандролон, предназначенный при кахексии различной этиологии, прогрессирующей мышечной дистрофии.
Пациентам в пожилом возрасте также следует проводить коррекцию питания, оказывать помощь в избавлении от депрессии и других расстройств.
Народные методы
В домашних условиях проводится лечение гипотрофии только легкой степени тяжести. Для этого назначается диета, пищеварительные ферменты, витаминные добавки.
Полезно проводить общеукрепляющие процедуры:
- Хвойная ванна. На полную ванну воды, не более 35°С, добавляется 2 таблетки хвойного концентрата. Если используется жидкий бальзам, то его необходимо 100 мл.
- Перед принятием ванны следует очистить тело под тёплым душем.
- Процедура не должна превышать 15-20 мин.
- После хвойной ванны следует ополоснуть тело прохладной водой.
Фитованна из разнообразных трав поможет снять усталость, нормализовать обмен веществ, улучшить кровообращение, укрепить иммунитет.
Предварительно из растительного сырья делается настой:
- Взять травы: чабрец – 2 ст. л., мята перечная – 2 ст. л., эвкалипт – 1 ст. л., цветы лаванды – 2 ст. л.
- Довести до кипения 2 л воды.
- Завернуть травы в марлевый мешочек, поместить в посуду с водой. Подождать, пока смесь закипит.
- После остывания процедить раствор и использовать для купания.
- Принимать ванну не более 20 мин. Следить, чтобы вода не покрывала грудную клетку.
Ежедневно следует добавлять белок в каждый прием пищи в течение дня. Вместо того чтобы наполнять тарелку продуктами с низким содержанием белка, такими как белый рис или картофель, необходимо есть больше орехов, семян, бобовых, домашней птицы, рыбы, яиц или молока, чтобы увеличить потребление белка.
Прочие методы
Комплексное лечение включает также ежедневный массаж и гимнастику. Больным показано регулярное плавание, не менее 3-4 ч/сутки, аэро — и гидропроцедуры, ежедневные прогулки на свежем воздухе. По показаниям проводится коррекция дисбактериоза, витаминотерапия.
Использование естественного солнечного освещения, УФ-лучей, оказывает полезное биологическое действие, вызывает положительную реакцию со стороны различных органов, показано при лечении гипотрофии.
Диагностика белково-энергетической недостаточности
Диагноз основывается на истории болезни, когда устанавливается явно неадекватное потребление пищи. Должна быть идентифицирована причина неадекватного питания, особенно у детей. У детей и подростков нужно обязательно иметь в виду возможность жестокого обращения и нервную анорексию.
Данные объективного обследования могут обычно подтвердить диагноз. Для идентификации причины вторичной белково-энергетической недостаточности необходимы лабораторные исследования. Измерение уровня альбумина плазмы, общего количества лимфоцитов, CD4+ Т-лимфоцитов и реакция на кожные антигены помогают определить тяжесть белково-энергетической недостаточности или подтвердить диагноз при пограничных состояниях. Проведение измерения уровня С-реактивного белка или растворимого рецептора интерлейкина-2 может помочь определить причину недостаточного питания при ее неясности и подтвердить нарушение продукции цитокинов. Многие дополнительные показатели могут отличаться от нормальных значений: например, характерны сниженные уровни гормонов, витаминов, липидов, холестерина, преальбумина, инсулиноподобного фактора роста-1, фибронектина и ретинолсвязывающего протеина. Уровни креатинина и метил-гистидина в моче могут использоваться как критерии оценки степени потери массы мышц. Поскольку катаболизм белка замедляется, уровень мочевины в моче также уменьшается. Эти данные редко учитываются при выборе тактики лечения.
С помощью других лабораторных тестов можно выявить и сопутствующие отклонения, которые требуют лечения. Должны быть определены уровни электролитов сыворотки, показатели мочевины и креатинина, BUN, глюкозы, возможно, Са, Мg, фосфата и Na. Уровни глюкозы крови и электролитов (особенно К, Са, Мд, фосфата, иногда Na) обычно низкие. Показатели мочевины и креатинина, BUN в большинстве случаев сохраняются на низких значениях, до развития почечной недостаточности. Возможно выявление метаболического ацидоза. Проводится общий анализ крови; обычно присутствует нормоцитарная анемия (главным образом из-за дефицита белка) или микроцитарная анемия (из-за одновременного дефицита железа).
Показатели, используемые для оценки тяжести белково-энергетической недостаточности
Показатель | Норма | Легкая | Умеренная | Тяжелая |
Нормальный вес (%) | 90-110 | 85-90 | 75-85 | |
Индекс массы тела (ИМТ) | 19-24 | 18-18,9 | 16-17,9 | |
Белок сыворотки (г/дл) | 3,5-5,0 | 3,1-3,4 | 2,4-3,0 | |
Трансферрин сыворотки (мг/дл) | 220-400 | 201-219 | 150-200 | |
Общее число лимфоцитов (в мм3) | 2000-3500 | 1501-1999 | 800-1500 | |
Индекс гиперчувствительности замедленного типа | 2 | 2 | 1 |
У пожилых ИМТ
Индекс гиперчувствительности замедленного типа показывает величину затвердения, выявляемого кожной пробой, с использованием общего антигена, полученного из Candida sp. или Trichophyton sp. Степень индурации 0 – 1,0 см.
Берется и анализ культуры кала на яйца глистов и паразитов, если понос тяжелый и не поддается лечению. Иногда исследуется анализ мочи, проводятся бактериологическое исследование мочи, бактериологические исследования крови, туберкулиновая проба и рентгенография грудной клетки с целью диагностики скрытых инфекций, потому что у людей с белково-энергетической недостаточностью может быть замедленная реакция на инфекции.
Лечение гипертонической болезни
Артериальная гипертензия — болезнь, которую нельзя окончательно вылечить, но можно контролировать. Терапия и изменение образа жизни позволяют остановить развитие гипертонии, уменьшить частоту и тяжесть кризов и убрать симптомы. Но самое главное — снизить риски для сердечно-сосудистой системы, головного мозга, почек.
Лечение начинают с коррекции образа жизни:
- отказ от курения;
- отказ от употребления алкоголя или существенное ограничение количества спиртного;
- диета: рацион корректируют, уменьшают потребление соли (менее 3,75 г в сутки), увеличивают количество овощей и фруктов (в идеале нужно 5 порций в день), цельнозерновых, молочных продуктов, продуктов со сниженной жирностью, ограничивают потребление калорий. Если нет противопоказаний и заболеваний почек, увеличивают употребление продуктов, содержащих калий (шпинат, фасоль, тыква, рыба, молоко, кефир, йогурт и другие);
- увеличение физической активности. Рекомендуют умеренные нагрузки, способствующие снижению веса и укреплению сердечно-сосудистой системы.
Артериальное давление при лечении снижают до целевых значений (ниже 130/80 мм рт. ст.), чтобы уменьшить риск осложнений. При таком снижении нужен постоянный контроль врача. Используемый для домашних измерений тонометр должен регулярно калиброваться
Для пациентов с диабетом, беременных женщин, пожилых и ослабленных людей применение антигипертензивных препаратов требует особой осторожности
Для лечения гипертонии могут использоваться:
- адренергические модификаторы. Снижают активность симпатической нервной системы и уменьшают кровяное давление, но могут вызывать сонливость, заторможенность, и поэтому применяются редко;
- ингибиторы АПФ. Уменьшают периферическое сосудистое сопротивление, часто назначаются больным с диабетом;
- блокаторы рецепторов ангиотензина II. Имеют действие, схожее с ингибиторами АПФ, а поэтому не назначаются вместе с ними. Не назначаются при беременности;
- бета-блокаторы. Обеспечивают снижение артериального давления за счет замедления сердечного ритма;
- блокаторы кальциевых каналов. Снижают общее периферическое сосудистое сопротивление, могут провоцировать рефлекторную тахикардию;
- прямые вазодилататоры. Оказывают прямое действие на кровеносные сосуды, применяются при тяжелой гипертонии;
- диуретики. Уменьшают объем плазмы крови, что позволяет снизить артериальное давление, но при этом могут спровоцировать гиперкалиемию.
Важно! Назначать лекарства и их дозировки должен терапевт или кардиолог после обследования. Прием лекарств без назначения врача может быть опасным
Если врач назначает прием лекарств, периодически нужно проходить контрольные осмотры, чтобы оценивать эффективность лечения и корректировать его
Важно скорректировать образ жизни, восстанавливать нормальное состояние здоровья так, чтобы для контроля течения гипертонической болезни требовалось минимальное количество медикаментов
Клиническая картина
Основные клинические симптомы Дистрофии: изменение веса и роста; задержка психомоторного развития; снижение сопротивляемости организма; диспептические расстройства. В большинстве случаев вес тела ребенка при Д. понижен, однако возможно и его повышение. Степень снижения веса может быть различной, вплоть до резкого отставания. Чрезмерное нарастание веса наблюдается при значительной задержке воды в организме. Дети вялы, малоподвижны, реакция на окружающее у них снижена. Отмечается склонность к различным инфекциям: гнойные процессы на коже, острые респираторные заболевания, пневмонии и т. д. При Д. развиваются клин, признаки витаминной недостаточности. Нарушения функции жел.-киш. тракта проявляются в виде изменения частоты стула и состава кала (см. Кал, особенности кала у детей). Стул задержан или учащается, изменяется его цвет, реакция, консистенция.
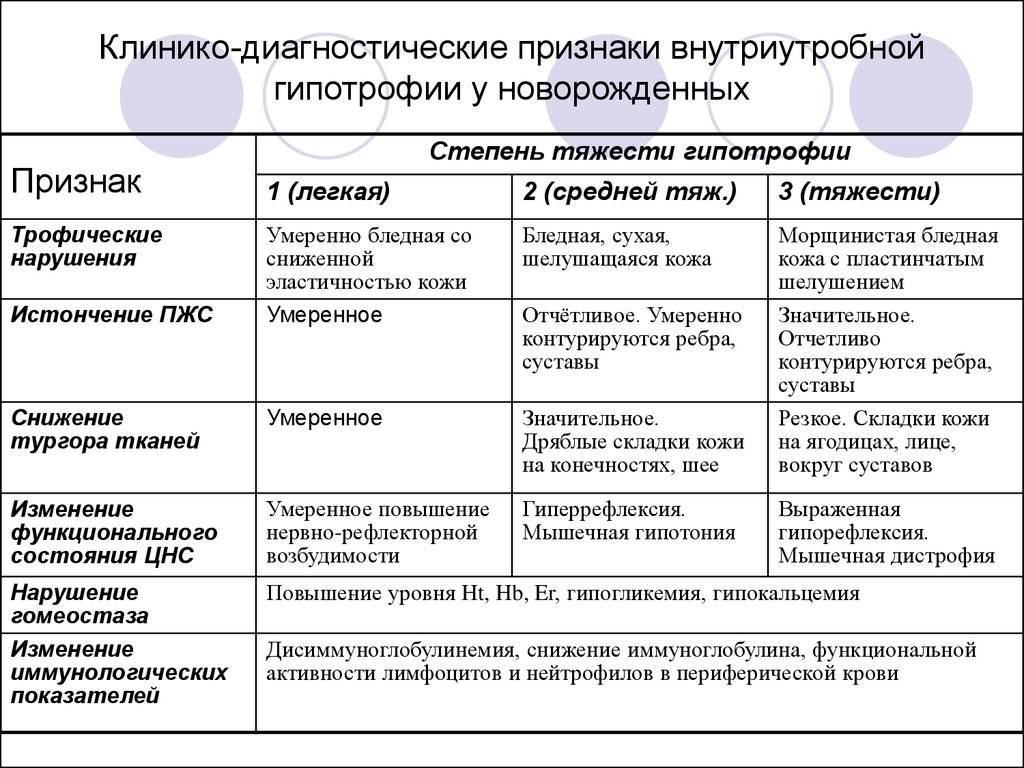
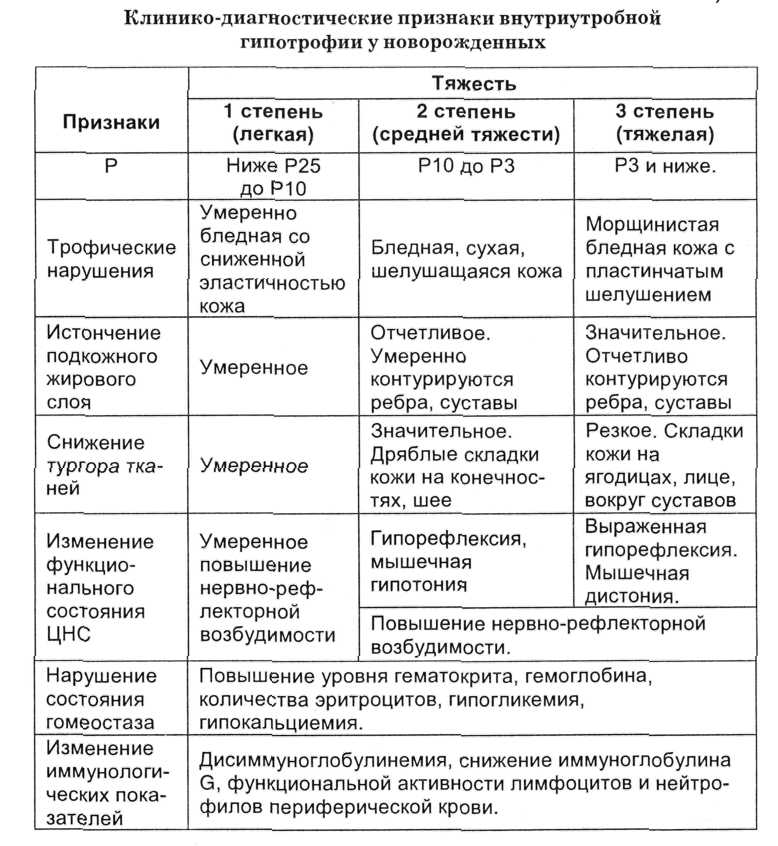
Тяжело протекающие внутриутробные гипотрофии делятся на четыре клинические формы: невропатическая, нейродистрофическая, нейроэндокринная, энцефалопатическая. Невропатическая форма характеризуется повышением возбудимости ребенка, расстройством сна, сокращением его продолжительности. Проявления гипотрофии нерезко выражены, развиваются после рождения, носят стойкий характер. При нейродистрофической форме ведущим симптомом является стойкое отставание в весе (см. Вес тела, ребенка), упорная анорексия (см.). Психомоторное развитие чаще несколько задержано, реже соответствует норме. Нейроэндокринная форма характеризуется стойким дефицитом веса и значительным отставанием в росте (см. Рост, у детей). При рождении выявляются нарушения телосложения типа гипофизарного нанизма (см. Карликовость), гемиасимметрии и т. д. В ряде случаев выявляются симптомы, связанные с нарушением функции желез внутренней секреции (см.). Психомоторное развитие детей несколько отстает. Энцефалопатическая форма проявляется тяжелой гипотрофией III степени (см. Гипотрофия), анорексией, значительным отставанием в психомоторном развитии.
В зависимости от сочетания признаков Д., характера изменения кожных покровов, их окраски, дефицита веса Клиффорд (S. Н. Clifford) в 1957 г. выделил три варианта внутриутробной Д. новорожденных, обозначающихся как синдром Клиффорда: Клиффорд I — главный признак — мацерация кожи; Клиффорд II и III — мацерация кожи, ее желтая окраска сочетается с гипотрофией различной степени. Синдром возникает при переношенной беременности вследствие комплексной дисфункции плаценты.
Диагноз ставят на основании клин, проявлений и показателей роста и веса.
Диагностика гипотрофии
В основе диагностики гипотрофии лежит не только определение факта наличия дефицита массы тела у ребенка, но и выяснение непосредственной причины развития данного патологического состояния. Обязательным этапом является осмотр ребенка педиатром, а также беседа с родителями, в ходе которой врач узнает все необходимые анамнестические данные. После тщательного физикального обследования ребенка и анализа анамнеза жизни и заболевания назначаются дополнительные лабораторные и инструментальные исследования, консультации узких специалистов (детского эндокринолога, гастроэнтеролога и др.).
Лабораторная диагностика обязательно должна включать в себя проведение общеклинических анализов (общего анализа крови и мочи), копрограммы, биохимического исследования крови с определением глюкозы, общего белка (а также его фракций), печеночных проб и других показателей.
Из инструментальных методов диагностики обязательным является проведение УЗИ органов брюшной полости, электрокардиографии (ЭКГ), эхокардиографии (УЗИ сердца).
По необходимости, при наличии показаний проводят и другие исследования, которые помогают определить основное заболевание, на фоне которого возникла гипотрофия.
Последствия белковой энергетической недостаточности
Неадекватность питания — не менее недели снижение поступления аминокислотных субстратов более 60% от нормы. В реальной жизни онкологического пациента период ограниченного потребления пищи может достигать нескольких недель, а восстановление естественного питания не гарантирует достаточного поступления нутриентов, в том числе из-за соблюдения диетических ограничений.
Осложнения недостаточного поступления зависят от объема белковых потерь и химического состава поступающих аминокислот, особенно тяжко организму без не синтезируемых им самим белков. Для продолжения функционирования организма недостаточное поступление компенсируется забором белковых субстратов из собственных тканей, особенно быстро уходят аминокислоты из печени, мышц и кожи. Истощение печеночной паренхимы нарушает обмен множества веществ. Потеря мышечного массива при активном злокачественном процессе — это кахексия, которая может протекать и без видимого снижения объёма жировой клетчатки. Сочетание распада белков мышц с нарушением аппетита у онкологического пациента получило название «синдром анорексии-кахексии».
Классификация
Для классификации заболевания применяют два подхода: по степеням и стадиям. Степени гипертонии различаются тем, до каких значений поднимается артериальное давление, разница между стадиями — в течении заболевания, в количестве, тяжести сопутствующих органических поражений.
Первая степень
Систолическое артериальное давление — более 139 и менее 159 мм рт. ст., а диастолическое находится на уровне 90-99 мм рт. ст. При повышенных значениях нормализовать кровяное давление можно, скорректировав образ жизни. Для этого нужно увеличить физическую активность, скорректировать питание, отказаться от вредных привычек, снизить уровень стресса.
Вторая степень
При второй степени значения артериального давления становятся высокими и составляют 160-179 мм рт. ст. для систолического и 100-109 мм рт. ст. для диастолического. При таких значениях нагрузка на сердце сильно увеличивается. Кровоснабжение головного мозга ухудшается, и это может вызывать головные боли и головокружение, снижение работоспособности. Возникают изменения на глазном дне. Начинается склероз тканей и сосудов почек, выделительная функция нарушается, возможно развитие почечной недостаточности. Состояние сосудов ухудшается. Для лечения нужно изменить образ жизни, а также начать прием лекарств.
Третья степень
Значение систолического давления — выше 180 мм рт. ст., диастолического — выше 110 мм рт. ст. При гипертонической болезни нагрузка на сердце становится слишком высокой и провоцирует необратимые изменения. Давление нужно постоянно снижать с помощью лекарств. Без этого возникает угроза острой сердечной недостаточности, аритмии, стенокардии, инфаркта миокарда, других тяжелых состояний. Пациентам с гипертонией третьей степени нужно постоянно находиться под наблюдением у врача. Необходим непрерывный прием лекарств, снижающих кровяное давление.
| Артериальное давление | Систолическое (мм рт. ст.) | Диастолическое (мм рт. ст.) |
|---|---|---|
| В норме | < 130 | < 85 |
| В норме, т.н. предгипертония | 130–139 | 85–89 |
| 1 — лёгкая степень гипертонии | 140–159 | 90–99 |
| 2 — умеренная степень гипертонии | 160–179 | 100–109 |
| 3 — тяжёлая степень гипертонии | ≥ 180 | ≥ 110 |